题目内容
(8分)将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度为 .反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率 .
(3)x的值是多少 .
(4)下列叙述能证明该反应已达到化学平衡状态的是 。
A.溶器内压强不再发生变化
B.A的体积分数不再发生变化
C.容器内气体分子总数不再发生变化
D.相同时间内消耗3nmolA的同时消耗nmolB
E. 混合气体的平均相对分子质量不再变化
3A(g)+B(g)
 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L。min),且此时A、B的物质的量浓度之比为3∶5。求:(1)此时A的浓度为 .反应开始前放入容器中A、B的物质的量
(2)B的平均反应速率 .
(3)x的值是多少 .
(4)下列叙述能证明该反应已达到化学平衡状态的是 。
A.溶器内压强不再发生变化
B.A的体积分数不再发生变化
C.容器内气体分子总数不再发生变化
D.相同时间内消耗3nmolA的同时消耗nmolB
E. 混合气体的平均相对分子质量不再变化
0.75 mol·L-1(1分)3mol(1分) ;0.05mol/(L。min);(2分);
x=2(2分) ; B(2分)
x=2(2分) ; B(2分)
(1)C的平均反应速率是0.1mol/(L。min),则生成C是0.5mol,剩余根据变化量之比是相应的化学计量数之比可知,x=2。则
3A(g)+B(g) xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) n n 0 0
转化量(mol) 1.5 0.5 1.0 1.0
平衡量(mol) n-1.5 n-0.5 1.0 1.0
所以有(n-1.5)∶(n-0.5)=3∶5
解得n=3mol,所以此时A物质的浓度是1.5mol÷2L=0.75mol/L
反应速率之比是相应的化学计量数之比
所以B物质的反应速率是0.1mol/(L。min)÷2=0.05mol/(L。min)
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确。反应前后条件不变,因此压强也是始终不变的,选项A、C不能说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变的,所以E不能说明,答案选B。
3A(g)+B(g)
 xC(g)+2D(g)
xC(g)+2D(g)起始量(mol) n n 0 0
转化量(mol) 1.5 0.5 1.0 1.0
平衡量(mol) n-1.5 n-0.5 1.0 1.0
所以有(n-1.5)∶(n-0.5)=3∶5
解得n=3mol,所以此时A物质的浓度是1.5mol÷2L=0.75mol/L
反应速率之比是相应的化学计量数之比
所以B物质的反应速率是0.1mol/(L。min)÷2=0.05mol/(L。min)
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项B正确。反应前后条件不变,因此压强也是始终不变的,选项A、C不能说明;D中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此D中的关系始终是成立,不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变的,所以E不能说明,答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CO2(g)+NO(g)ΔH <0的反应,达到平衡后,降低温度,混合气体的颜色
CO2(g)+NO(g)ΔH <0的反应,达到平衡后,降低温度,混合气体的颜色 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是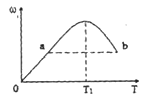
 xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为
xC(气)+yD(气)达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为  pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是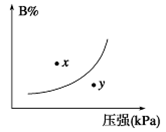
 p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是
p C(g), 达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍,下列说法中错误的是  Fe(固)+CO2(气) △H﹤0。已知1100℃时,K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
Fe(固)+CO2(气) △H﹤0。已知1100℃时,K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。 CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是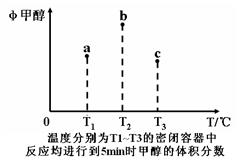
 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是