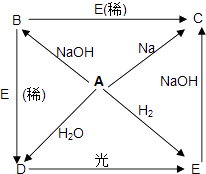
题目内容
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
A.降低了反应的活化能
B.增大了反应的速率
C.降低了反应的焓变
D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。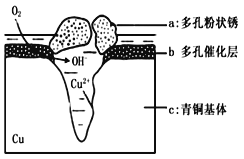
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
【答案】
(1)四
(2)10:1
(3)A,B
(4)Ag2O +2CuCl=2AgCl+Cu2O
(5)c;2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;0.448
【解析】(1)铜为29号元素,根据核外电子排布规则可知,铜元素位于元素周期表中第四周期。
(2)根据![]() 青铜器中
青铜器中![]() 、
、![]() 的质量分别为
的质量分别为![]() 、
、![]() ,则核青铜器中
,则核青铜器中![]() 和
和![]() 原子数:目之比为
原子数:目之比为![]()
(3)催化剂能降低反应的活化能,从而加快化学反应速率,但是催化剂不能改变反应的焓变,也不能改变化学平衡常数,选![]() 、
、![]() .
.
(4)![]() 与
与![]() 发生复分解反应,没有化合价的降,则化学方程式为
发生复分解反应,没有化合价的降,则化学方程式为![]()
(5)①根据图示,腐蚀过程中,铜失球好生成![]() 则负极是铜,选C;
则负极是铜,选C;
②根据上述分析,正极产物是![]() , 负极产物为
, 负极产物为![]() ·,环境中的
·,环境中的![]() 扩散到孔口,与正极反应产物和负极反应产物作用生成多孔粉状锈
扩散到孔口,与正极反应产物和负极反应产物作用生成多孔粉状锈![]() 则离子方程式
则离子方程式![]()
③![]() 的物质的量为
的物质的量为![]() 根据铜原子守恒,
根据铜原子守恒,![]() 的物质的量为
的物质的量为![]() , 负极反应为:
, 负极反应为:![]() 正极反应为
正极反应为![]() 根据正负极放电量相等,则理论上耗氧体积为
根据正负极放电量相等,则理论上耗氧体积为![]() .
.
【考点精析】通过灵活运用金属的电化学腐蚀与防护和催化剂,掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法;催化剂的催化作用具有很强的选择性,某种催化剂往往只能催化某一种反应或某一类反应,使用生物酶制剂时的选择性更为突出即可以解答此题.