题目内容
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 ?????????????????????????????????????????????????????????????????? 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s)??? ? △H=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)? △H=+116.5 kJ·mol-1
③H2O(1)=H2O(g)? ??????????????????? △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式?????????????????
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为??????????????? ;每消耗3.4g NH3转移的电子数为??????????????? (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)? △H=Q kJ·mol-1。
N2(g)+CO2(g)? △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
???????? 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ????? ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是? ?? ? (填字母编号)。
a.加入一定量的活性炭 ???? b.通人一定量的NO
c.适当缩小容器的体积?????? d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q ??? 0(填“>”或“<”)。?
(1)4NH3+5O2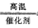 4NO+6H2O? (2)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l);△H=-87.0kJ/mol
4NO+6H2O? (2)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l);△H=-87.0kJ/mol
(3)2NH3+6OH- -6e-=N2+6H2O?? 0.6NA。(4)①9/16(或0.56)? ②bc? ③<.
【解析】
试题分析:(2)由盖斯定律方程式①+②-③得热化学方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l);△H=-87.0kJ/mol;(3)由原电池原理,结合电解质溶液的碱性确定负极反应式为2NH3+6OH- -6e-=N2+6H2O? ;每消耗3.4g NH3转移的电子数为0.6NA;(4)由平衡常数的表达式确定T1℃时,该反应的平衡常数K=c(N2)×c(CO2)/c2(NO)=0.56;30min后气体的浓度均增大,所以可能是通入的NO或缩小了容器的体积;升高温度时三种气体的浓度比值与T1℃平衡状态下增大,所以确定平衡逆向移动,Q <0.
考点:元素化合物知识、盖斯定律、原电池原理、化学平衡及其常数。

(1)以CO2和NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159kJ?mol-1
②NH2CO2NH4(S)═CO(NH2)2(s)+H2O(g)△H=1165kJ?mol-1
③H2O(l)═H2O(g)△H=44.0kJ?mol-1
则反应2NH3(g)═CO(NH2)2(s)+H2O(l)的△H=______kJ?mol-1.
(2)用活性炭原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:
C(s)+2NO(g)?N2(g)+CO2(g)△H=QkJ?mol-1.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 10 | 20 | 30 | 40 | 50 | |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 | |
| CO2 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到的平衡,根据上表中的数据判断改变的条件可能是______(填字母代号);
a.加入一定量的活性炭
b.通入一定量的NO
c.适当缩小容器的体积
d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中,NO、N3、CO2的浓度之比为5:3:3,则Q______0(填“>”或“<”).
 +
+
 =
=  + 2
+ 2 △H = -725.5
kJ·mol-1
△H = -725.5
kJ·mol-1
 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为
;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1
氨水V2 L混合,若混合溶液pH = 7,则V1 和V2 的关系为:V1 V2
(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为
;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1
氨水V2 L混合,若混合溶液pH = 7,则V1 和V2 的关系为:V1 V2
(填“>”、“<”或“=”)。