题目内容
11.T℃时,在2L的密闭容器中,A气体与B气体发生可逆反应生成C气体,反应过程中A、B、C物质的量变化如图(Ⅰ)所示.若保持其他条件不变,温度分别为T1和T2时,B的物质的量分数与时间关系如图(Ⅱ)所示.下列叙述正确的是( )
| A. | 2min内A的化学反应速率为0.1 mol/(L•min) | |
| B. | 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动 | |
| C. | 在反应达平衡时,其他条件不变,升高温度,正逆反应速率都增大,且A的转化率增大 | |
| D. | T1和T2时的平衡常数大小关系:前者小于后者 |
分析 该反应达到平衡状态时,A物质的量的变化量=(0.5-0.3)mol=0.2mol,B物质的量的变化量=(0.7-0.1)mol=0.6mol,C物质的量的变化量=(0.4-0)mol=0.4mol,同一化学反应同一时间段内,各物质的量的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的物质的量分数发生增大,则该反应的正反应是放热反应;
A.根据V=$\frac{△c}{△t}$计算;
B.增大压强,正逆反应速率都增大,平衡向气体体积减小的方向移动;
C.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动;
D.根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,平衡向吸热反应方向移动.
解答 解:反应达到平衡状态时,A物质的量的变化量=(0.5-0.3)mol=0.2mol,B物质的量的变化量=(0.7-0.1)mol=0.6mol,C物质的量的变化量=(0.4-0)mol=0.4mol,同一化学反应同一时间段内,各物质的量的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的物质的量分数发生增大,则该反应的正反应是放热反应;
A.2min内A的化学反应速率V=$\frac{△c}{△t}$=$\frac{\frac{0.2}{2}}{2}$=0.05mol/(L•min),故A错误;
B.该反应的正反应是气体体积减小的反应,t2时,保持其它条件和物质状态不变,增加压强,正逆反应速率都增大,化学平衡向正反应方向移动,故B错误;
C.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故C错误;
D.因为T1>T2,升高温度,平衡向吸热反应方向即逆反应方向移动,所以温度低K大,则T1和T2时的平衡常数大小关系:前者小于后者,故D正确;
故选:D.
点评 本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案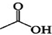 +
+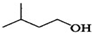 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(3)本实验中加入过量乙酸的目的是提高醇的转化率.
(4)实验中加入少量无水MgSO4的目的是干燥乙酸异戊酯.
(5)在蒸馏操作中,图2中仪器选择及安装都正确的是b(填标号).
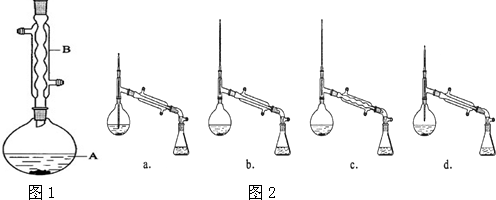
(6)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”),原因是会收集少量未反应的异戊醇.
(7)本实验的产率是c(填标号).a.30% b.40% c.60% d.90%
| A. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 水溶液中Fe2+、H+、SO${\;}_{3}^{2-}$、ClO-不能大量共存 |
| A. | 常温常压下,11.2LNH3所含的原子数为2NA | |
| B. | 常温常压下,80gSO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LH2中所含原子数为NA | |
| D. | 2 L0.3 mol•L-1 Na2SO4溶液中含0.6NA个Na+ |
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 用做感光片的溴化银贮存在无色试剂瓶中 | |
| C. | 烧碱溶液放在带磨口玻璃塞的试剂瓶中 | |
| D. | 1mol/L NaCl溶液不能长期保存在容量瓶中 |
| A. | Fe与S混合加热生成FeS | |
| B. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 | |
| C. | 检验SO2气体中是否含有CO2气体,可将气体先通入饱和碳酸氢钠溶液,再通入品红溶液,最后通入澄清石灰水溶液 | |
| D. | 氯化氢水溶液能导电,所以氯化氢是电解质 |
 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.