题目内容
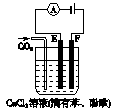
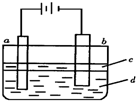
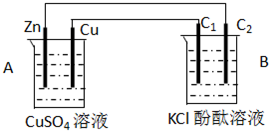
按如图所示装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为______,B池为______.
(2)锌极为______极,电极反应式为______;铜极为______极,电极反应式为______;石墨棒C1为______极,电极反应式为______;石墨棒C2附近发生的实验现象为______.
(3)当C2极析出224mL气体(标准状况下),锌的质量变化为(增加或减少)______g.CuSO4溶液的质量变化为(增加或减少)______g.
(4)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是______
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.
(1)判断装置的名称:A池为______,B池为______.
(2)锌极为______极,电极反应式为______;铜极为______极,电极反应式为______;石墨棒C1为______极,电极反应式为______;石墨棒C2附近发生的实验现象为______.
(3)当C2极析出224mL气体(标准状况下),锌的质量变化为(增加或减少)______g.CuSO4溶液的质量变化为(增加或减少)______g.
(4)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解.电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍.以下说法正确的是______
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子.

该装置中A能自发的进行氧化还原反应为原电池,B为电解池,锌易失电子作负极,铜作正极,B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,阴极上氢离子放电;A中锌电极上失电子生成锌离子进入溶液,铜电极上铜离子得电子生成铜单质,所以其电池反应式为Zn+Cu2+=Cu+Zn2+;
(1)A能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)该装置中A能自发的进行氧化还原反应为原电池,B为电解池,锌易失电子作负极,电极反应为:Zn-2e-=Zn2+;铜作正极,溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-=Cu;B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,电极反应为:2Cl--2e-=Cl2↑;阴极上氢离子放电,电极反应为2H++2e-=H2↑,电极上有气体生成,溶液中水的电离平衡正向进行,氢氧根离子浓度增大,负极附近的溶液遇到酚酞变红色;
故答案为:负;Zn-2e-=Zn2+;正;Cu2++2e-=Cu;阳;2Cl--2e-=Cl2↑;有无色气体产生;附近溶液出现红色;
(3)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=
=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,
CuSO4溶液的质量变化,依据化学方程式和溶液质量变化计算,B装置中的离子方程式;
Zn+Cu2+=Cu+Zn2+,溶液质量增加△m
1 65g-64g=1g
0.01mol 0.01g
CuSO4溶液的质量变化为增加0.01g;
故答案为:减少0.65,增加0.01;
(4)A.若Fe为阳极,则氯离子不能在阳极生成,则不会存在产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,故A错误;
B.电解时阳极附近氯离子放电,溶液的pH不会升高,故B错误;
C.电解时阳极附近氯离子放电,发生电极反应为2Cl--2e-═Cl2,故C正确;
D.由Ni2+-e-═Ni3+可知1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故D正确;
故选:CD.
故答案为:CD;
(1)A能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,B有外接电源,属于电解池,故答案为:原电池;电解池;
(2)该装置中A能自发的进行氧化还原反应为原电池,B为电解池,锌易失电子作负极,电极反应为:Zn-2e-=Zn2+;铜作正极,溶液中铜离子得到电子生成铜,电极反应为:Cu2++2e-=Cu;B中连接铜的电极为阳极,连接锌的电极为负极,电解池中阳极上氯离子放电,电极反应为:2Cl--2e-=Cl2↑;阴极上氢离子放电,电极反应为2H++2e-=H2↑,电极上有气体生成,溶液中水的电离平衡正向进行,氢氧根离子浓度增大,负极附近的溶液遇到酚酞变红色;
故答案为:负;Zn-2e-=Zn2+;正;Cu2++2e-=Cu;阳;2Cl--2e-=Cl2↑;有无色气体产生;附近溶液出现红色;
(3)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e-=2H2↑+4OH-,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=
| 0.224L |
| 22.4L/mol |
CuSO4溶液的质量变化,依据化学方程式和溶液质量变化计算,B装置中的离子方程式;
Zn+Cu2+=Cu+Zn2+,溶液质量增加△m
1 65g-64g=1g
0.01mol 0.01g
CuSO4溶液的质量变化为增加0.01g;
故答案为:减少0.65,增加0.01;
(4)A.若Fe为阳极,则氯离子不能在阳极生成,则不会存在产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍,故A错误;
B.电解时阳极附近氯离子放电,溶液的pH不会升高,故B错误;
C.电解时阳极附近氯离子放电,发生电极反应为2Cl--2e-═Cl2,故C正确;
D.由Ni2+-e-═Ni3+可知1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子,故D正确;
故选:CD.
故答案为:CD;

练习册系列答案
相关题目