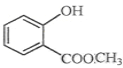
题目内容
【题目】已知元素A的原子序数是53,请根据元素周期表的编排原则完成下列问题:
(1) A元素在周期表中的位置____。
(2) A的氢化物中含有化学键的类型____。(填共价键、离子键)
(3)与A同主族的元素形成的最高价氧化物的水化物中酸性或碱性最强的是______。(填化学式)
(4)写出A与H2反应的化学方程式_______
【答案】第五周期第ⅦA 共价键 HClO4 I2+H2![]() 2HI
2HI
【解析】
元素A的原子序数是53,为碘元素,在元素周期表中位于第五周期第ⅦA,属卤族元素,可结合卤族元素的性质递变规律分析解题。
(1) 碘元素的原子序数为53,在元素周期表中位于第五周期第ⅦA;
(2)碘的氢化物为HI,分子中含有化学键的类型共价键;
(3)与I同主族的元素中,氯元素形成的最高价氧化物的水化物高氯酸的酸性最强,其含氧酸的化学式为HClO4;
(4)碘与H2在加热条件下生成HI,不稳定易分解,属可逆反应,其化学方程式为I2+H2![]() 2HI。
2HI。

【题目】I、下图是全钒液流电池的示意图

该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。

(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。