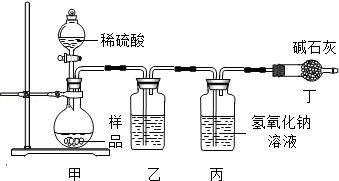
题目内容
4.下列有关说法中正确的是( )| A. | CO2或SO2都会导致酸雨的形成 | |
| B. | 苯与溴水在铁催化下可发生取代反应 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 电解水生成H2和O2的实验中,可加入少量盐酸增强导电性 |
分析 A.根据酸雨的形成原因解答;
B.苯与溴水不反应;
C.生铁中含有杂质,更容易发生电化学腐蚀;
D.加入盐酸,阳极生成氯气.
解答 解:A.酸雨的形成是由于SO2、NO2而引起的,与CO2无关,故A错误;
B.苯与溴水不反应,与液溴在铁催化作用下生成溴苯,故B错误;
C.生铁中含有杂质,更容易发生电化学腐蚀,因此生铁更易腐蚀,故C正确;
D.由于氯离子放电,加入盐酸在阳极上生成氯气,不能用盐酸酸化,故D错误;
故选:C.
点评 本题为综合题,考查了酸雨的成因、苯的结构与性质、金属的腐蚀与防护、电解,熟悉相关知识是解题关键,注意对基础知识的积累.

练习册系列答案
相关题目
1.将一定量的铁粉加入到一定量的硝酸银和硝酸镁的混合液中,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则在滤渣中( )
| A. | 一定有银、铁和镁 | B. | 仅有银和铁 | C. | 可能含镁 | D. | 只有银 |
15.某酸性FeSO3溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是铁粉和稀硫酸.
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
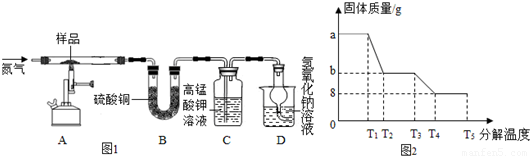
①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫.
②实验中要持续通入氮气,否则测出的x会偏小(填“偏于”、“偏于”或“不变”).
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液.
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC.
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.

①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫.
②实验中要持续通入氮气,否则测出的x会偏小(填“偏于”、“偏于”或“不变”).
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液.
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
19.描述分子结构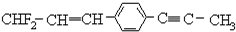 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
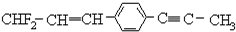 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 12个碳原子不可能都在同一平面上 | |
| B. | 处于同一直线上的原子最多有4个 | |
| C. | 处在同一平面上的原子最多有20个 | |
| D. | 除苯环外的其余碳原子有可能都在同一直线上 |
9.下列实验能获得成功的是( )
| A. | 新制Cu(OH)2浊液可鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液 | |
| B. | 用无水乙醇、冰醋酸、3mol/L硫酸制乙酸乙酯 | |
| C. | 苯、溴水、铁粉混合制成溴苯 | |
| D. | 可用分液漏斗分离甘油和水 |
16.在一定温度下的定容密闭容器中,下列情况能表明可逆反应:H2(g)+I2(g)?2HI(g)已达平衡的是( )
| A. | H2的生成速率与I2的生成速率相等 | |
| B. | 若单位时间内生成n mol H2的同时生成2n mol HI | |
| C. | H2、I2、HI的浓度相等 | |
| D. | 反应容器内的压强不随时间的变化而变化 |
13.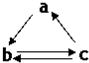 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | SO3 | H2SO4 | S |
| A. | A | B. | B | C. | C | D. | D |