题目内容
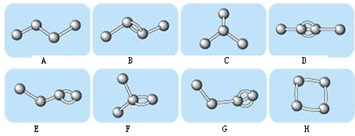
(1)图中属于烷烃的是
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成
(3)上图中互为同分异构体的是:A与
(2)碳原子之间成键方式具有多样性,可以成碳链可以成碳环,可以形成双键、单键、三键;
(3)分子式相同而结构不同的有机化合物互为同分异构体.
(2)碳原子之间成键方式具有多样性,碳原子与碳原子之间不仅可以形成共价单键,还可以形成双键、单键,不仅可以形成碳链还可以形成碳环,
故答案为:碳碳双键;碳碳叁键;碳链;
(3)A和C,B和E、F、H,以及D与G,分子式相同而结构不同,它们之间互为同分异构体,故答案为:C;E、F、H;G.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案(12分)
A.下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
|
| |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表
的 区。
(2)②、⑥两元素形成的化合物的空间构型为 ,其中心原子的杂化类型为 。
(3)写出元素⑧基态原子的电子排布式 。
(4)①③两元素形成的最简单的化合物与 (写微粒符号)互为等电子体。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于___ 晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力
为 。
(7) 金属⑦的晶体在不同温度下有两种堆积方式,晶胞分 别如右图所示。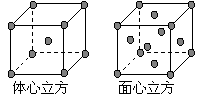 则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为 。
B.(12分)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
CH3CH2OH(g)+3H2O(g)①,25℃时, K=2.95×1011
2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
CH3CH2OH(g)+H2O(g)②,25℃时, K=1.71×1022
(1)写出反应①的平衡常数表达式K=__________________。
(2)条件相同时,反应①与反应②相比,转化程度更大的是________。以CO2为原料合成乙醇的优点是 (写出一条即可)。
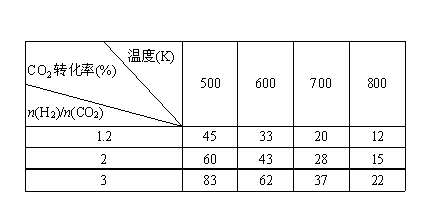 |
(3)在一定压强下,测得反应①的实验数据如下表:
根据表中数据分析:
①温度升高,K值______(填“增大”、“减小”或“不变”)。
②提高氢碳比[ n(H2)/n(CO2)],对生成乙醇 (填“有利”、“不利”)。
 (4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
(4)在下图的坐标中作图说明压强变化对反应①的化学平衡的影响。(必须在图中标明坐标轴所表示的物理量。
 ①
①