题目内容
将x mol CO和y mol H2的混合气体充入盛有足量Na2O2的密闭容器中,再通入z mol O2,并用电火花点燃使其充分反应,有关容器内反应的叙述不正确的是…( )A.参加反应的Na2O2为:(x+y)mol
B.反应后容器中有O2:(x+y)×![]() mol
mol
C.反应前后容器内压强比值为(温度不变):![]()
D.反应后生成了x mol Na2CO3和2y mol NaOH
BC
解析:充分反应应视为某一反应物直至反应尽。本题条件是Na2O2足量,则指CO和H2反应完。根据前面所述的结论:Na2O2吸收CO2和H2O实际是吸收CO和H2,且1 mol Na2O2吸收1 mol CO或1 mol H2。所以,参加反应的Na2O2为(x+y)mol。由C原子守恒和H原子守恒的关系,可知生成的Na2CO3为x mol,生成的NaOH为2y mol。由于反应过程中实际是不消耗O2的,原O2可认为是一个引发剂,原来有多少反应后仍有多少。所以z可为大于0的任意值,并不一定等于![]() mol,
mol,![]() mol只是若干种可能中的一种。根据公式:
mol只是若干种可能中的一种。根据公式:![]() ,所以前后容器内压强之比为
,所以前后容器内压强之比为![]() 。
。

(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +2H2(g) CH3OH(g) ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH 0 (填“>”、“=”或“<”);
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,此时的温度为 。
(2)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇)。
(3)300℃、1.01×105Pa下,上述反应的ΔH数值为90.8 kJ/mol。在该温度下,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应放出或吸收的能量 | x kJ | y kJ | z kJ | |
| 反应物转化率 | Ф1 | Ф2 | Ф3 |
请比较以下每组数据的大小(填“>”、“<”或“=”):
①2c1 c3 ② x+y 90.8 ③Ф1+Ф3 1
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g) 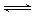 CH3OH(g) ΔH
CH3OH(g) ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)= 0.2 mol/L,此时的温度为 。
(2)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇)。

(3)300℃、1.01×105Pa下,上述反应的ΔH数值为90.8 kJ/mol。在该温度下,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应放出或吸收的能量 | x kJ | y kJ | z kJ | |
| 反应物转化率 | Ф1 | Ф2 | Ф3 | |
①2c1 c3 ② x+y 90.8 ③Ф1+Ф3 1
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +
2H2(g) 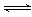 CH3OH(g)
ΔH
CH3OH(g)
ΔH
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)。
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断ΔH 0 (填“>”、“=”或“<”);
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)= 0.2 mol/L,此时的温度为 。
(2)T℃时,在时间t0时刻,合成甲醇反应达到平衡,若在t1时刻将容器的体积缩小一倍,假定在t2时刻后又达到新的平衡,请在图中用曲线表示在t1~t2阶段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其它条件不变,曲线上必须标明氢气、甲醇)。
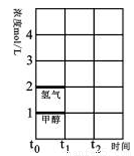
(3)300℃、1.01×105Pa下,上述反应的ΔH数值为90.8 kJ/mol。在该温度下,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1 mol CO、2 mol H2 |
1 mol CH3OH |
2 mol CH3OH |
|
|
平衡时数据 |
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应放出或吸收的能量 |
x kJ |
y kJ |
z kJ |
|
|
反应物转化率 |
Ф1 |
Ф2 |
Ф3 |
请比较以下每组数据的大小(填“>”、“<”或“=”):
①2c1 c3 ② x+y 90.8 ③Ф1+Ф3 1