题目内容
【题目】硼及其化合物在现代工业、生活和国防中有着重要的应用价值。
(1)最简单的硼烷是B2H6(乙硼烷),结构如图所示,其中B原子的杂化方式为________。

(2)三氯化硼和三氟化硼常温下都是气体,都有强烈的接受孤电子对的倾向。推测它们固态时的晶体类型为________;三氟化硼与氨气相遇,立即生成白色固体,写出该白色固体结构式,并标注出其中的配位键________。
(3)经结构研究证明,硼酸晶体中B(OH)3单元结构如图Ⅰ所示。各单元中的氧原子通过O—H…O氢键连结成层状结构,其片层结构及键长、层间距数据如图Ⅱ所示。层与层之间以微弱的分子间力相结合构成整个硼酸晶体。

①H3BO3是一元弱酸,写出它在水中的电离方程式(与氨类似)_____________________;
②根据结构判断下列说法正确的是________;
a.硼酸晶体有滑腻感,可作润滑剂
b.H3BO3分子的稳定性与氢键有关
c.含1 mol H3BO3的晶体中有3 mol氢键
d.H3BO3分子中硼原子最外层为8e-稳定结构
(4)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图为其晶胞结构示意图。

①该功能陶瓷的化学式为________________;
②第一电离能介于B、N之间的第二周期元素有________种。
【答案】 sp3杂化 分子晶体 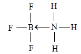 H3BO3+H2O
H3BO3+H2O![]() [B(OH)4]-+H+ ac BN 3
[B(OH)4]-+H+ ac BN 3
【解析】(1)根据每个硼原子含有4个共价键判断;
(2)根据常温下都是气体判断晶体类型;根据氮原子提供孤电子对,硼原子接受孤对电子分析;
(3)①根据与氨类似,进行迁移应用即可;
②根据硼酸晶体的结构特点分析解答;
(4)①根据均摊法计算该功能陶瓷的化学式;
②根据影响第一电离能大小的因素分析判断。
(1)乙硼烷分子中每个硼原子含有4个共价键,所以B原子采用sp3杂化;
(2)常温下为气体,说明晶体构型为分子晶体;硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,BF3能与NH3反应生成BF3NH3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,BF3NH3结构式为: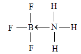 ;
;
(3)①硼酸为一元弱酸,在水溶液里,和水电离出的氢氧根离子形成配位键,其电离方程式为:H3BO3+H2O![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
②a.硼酸(H3BO3)是一种片层状结构白色晶体,片层状结构晶体有滑腻感,可作润滑剂,a正确;
b.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,b错误;
c.1个硼酸分子形成了6个氢键,但每个氢键是2个硼酸分子共用的,所以平均含3个氢键,则含有1molH3BO3的晶体中有3mol氢键,c正确;
d.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,d错误;
答案选ac;
(5)①根据原子半径大小知,B原子半径大于N原子,所以大球表示B原子,利用均摊法得B原子个数=1+8×1/8=2,N原子个数=1+4×1/4=2,B原子和N原子个数之比为2:2=1:1,所以其化学式为BN;
②同一周期元素中,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能介于B、N之间的第二周期元素有Be、C、O3种;

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案