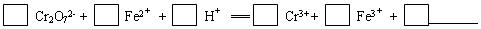题目内容
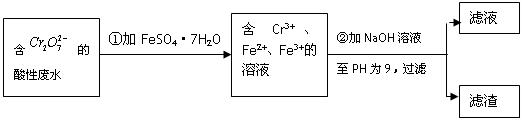
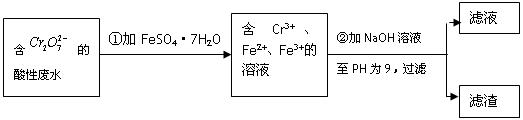
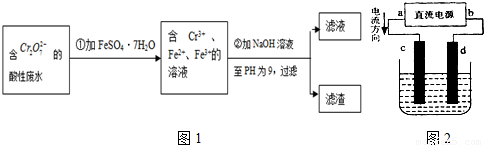
化学试剂的生产和电镀工业排放的废水中常含有20~100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1.工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验1流程:
(1)配平第①步反应的离子方程式:______Cr2O72-+______Fe2++______H+═______Cr3++______Fe3++____________
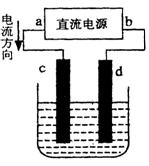
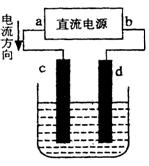
(2)设计一个电解装置也可以实现上述目的,装置如图2(用铁棒和石墨作电极):
电极材料c为:______
d极电极反应为:______
(3)已知:25℃时Ag2Cr2O7的Ksp=2×10-7.则25℃时,将4×10-2mol?L-1的AgNO3溶液与4×10-4mol?L-1的K2Cr2O7溶液等体积混合______(填“能”或“不能”) 析出沉淀.
解:(1)反应中Cr2O72-→Cr3+,Cr元素化合价由+6价降低为+3价,共降低6价.Fe2+→Fe3+,Fe元素的化合价由+2价升高为+3价,共升高1价,化合价升降最小公倍数为6,故Cr2O72-的系数为1,Fe2+的系数为6,根据原子守恒Cr3+的系数为2,Fe3+的系数为6,由电荷守恒可知H+的系数为14,由H、O原子是之比为2:1,故缺项物质为H2O,其系数为7,配平后方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:1;6;14;2;6;7H2O;
(2)由电流的流向可知,c为阳极、d为阴极,需要提供Fe2+离子,故Fe应做阳极,及c电极材料为铁棒.阴极氢离子放电产生氢氧根离子,氢氧根离子与Cr3+、Fe3+反应转化为沉淀,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:铁棒;2H2O+2e-=H2↑+2OH-;
(3)将4×10-2mol?L-1的AgNO3溶液与4×10-4mol?L-1的K2Cr2O7溶液等体积混合后Ag+的浓度为2×10-2mol?L-1,Cr2O72-的浓度为2×10-4mol?L-1,二者浓度积为(2×10-2)2×(2×10-4)=8×10-8,<2×10-7,故不能析出沉淀,
故答案为:不能.
分析:(1)反应中Cr2O72-→Cr3+,Cr元素化合价由+6价降低为+3价,共降低6价.Fe2+→Fe3+,Fe元素的化合价由+2价升高为+3价,共升高1价,化合价升降最小公倍数为6,故Cr2O72-的系数为1,Fe2+的系数为6,再结合原子守恒、电荷守恒确定缺项物质,配平其它物质系数;
(2)由电流的流向可知,c为阳极、d为阴极,需要提供Fe2+离子,故Fe应做阳极;阴极氢离子放电产生氢氧根离子,氢氧根离子与Cr3+、Fe3+反应转化为沉淀;
(3)计算混合后Ag+、Cr2O72-的浓度,计算浓度积,与溶度积相比进行判断.
点评:本题考查氧化还原反应配平、电解原理、对工艺流程的理解、溶度积的计算与应用,难度中等,(3)中注意利用混合的浓度进行计算.
故答案为:1;6;14;2;6;7H2O;
(2)由电流的流向可知,c为阳极、d为阴极,需要提供Fe2+离子,故Fe应做阳极,及c电极材料为铁棒.阴极氢离子放电产生氢氧根离子,氢氧根离子与Cr3+、Fe3+反应转化为沉淀,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:铁棒;2H2O+2e-=H2↑+2OH-;
(3)将4×10-2mol?L-1的AgNO3溶液与4×10-4mol?L-1的K2Cr2O7溶液等体积混合后Ag+的浓度为2×10-2mol?L-1,Cr2O72-的浓度为2×10-4mol?L-1,二者浓度积为(2×10-2)2×(2×10-4)=8×10-8,<2×10-7,故不能析出沉淀,
故答案为:不能.
分析:(1)反应中Cr2O72-→Cr3+,Cr元素化合价由+6价降低为+3价,共降低6价.Fe2+→Fe3+,Fe元素的化合价由+2价升高为+3价,共升高1价,化合价升降最小公倍数为6,故Cr2O72-的系数为1,Fe2+的系数为6,再结合原子守恒、电荷守恒确定缺项物质,配平其它物质系数;
(2)由电流的流向可知,c为阳极、d为阴极,需要提供Fe2+离子,故Fe应做阳极;阴极氢离子放电产生氢氧根离子,氢氧根离子与Cr3+、Fe3+反应转化为沉淀;
(3)计算混合后Ag+、Cr2O72-的浓度,计算浓度积,与溶度积相比进行判断.
点评:本题考查氧化还原反应配平、电解原理、对工艺流程的理解、溶度积的计算与应用,难度中等,(3)中注意利用混合的浓度进行计算.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: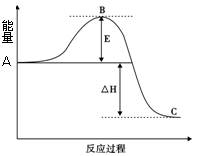
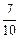 ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)