��Ŀ����
����Ŀ��ʵ���⣺�̷���FeSO4��7H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֡���������������м��������������������������Ϊԭ�����������̷���һ�ַ�����

��֪�������±��� H2S��Һ�� pH ԼΪ3.9��SnS������ȫʱ��Һ�� pH Ϊ1.6��FeS��ʼ����ʱ��Һ�� pH Ϊ3.0��������ȫʱ�� pH Ϊ5.5��
��1�� ������������Һ���������ữ�� pH��2��Ŀ����_______________________��
��2����������˳������Ϊ________��________�����ˡ�ϴ�ӡ����
��3���������õ����̷�������������ˮϴ�ӣ���Ŀ������
����ȥ������渽�ŵ���������ʣ�
��________________________________________________________________________��
��4���ⶨ�̷���Ʒ��Fe2�������ķ�����
a����ȡһ���������̷���Ʒ�����Ƴ�250.00 mL��Һ��
b����ȡ25.00 mL ������Һ����ƿ�У�
c���������ữ�� 0.010 00 mol��L��1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00 mL��
�ζ�ʱ������Ӧ�����ӷ���ʽΪ5Fe2����MnO4����8H��===5Fe3����Mn2����4H2O
���������ữ�� 0.010 00 mol��L��1 KMnO4��Һ�ζ�ʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�ı仯�жϴ˵ζ�ʵ��ﵽ�յ�ķ�����___________________��
���������������ⶨ����Ʒ��FeSO4��7H2O����������ƫ�����ⶨ�����в��������ɺ������������ԭ����___ _��
���𰸡���1��ʹ Sn2��������ȫ����ֹ Fe2�����ɳ��� ��2������Ũ�� ��ȴ�ᾧ
��3������ϴ�ӹ����� FeSO4��7H2O�����
��4�����μ����һ��KMnO4��Һ����Һ���dz��ɫ�Ұ�����ڲ���ɫ
����Ʒ�д������������ʻ���Ʒ���ֱ�����
��������
�����������1������������Һ���������ữ��pH=2��Ŀ���ǣ�����ҺPH=2ʱ��Sn2+��ȫ�������������Ӳ�������
��2����Һ�еõ����壬��Ҫ����Һ���м�������Ũ�����ᾧ����������ϴ�ӵȣ����Բ���IV��˳������Ϊ���������ᾧ�����ˡ�ϴ�ӣ�
��3����ˮ�¶ȵͣ������ܽ�ȼ�С������ϴȥ����������������ӣ������̷��ܽ��������ʧ��
��4�����ζ�ʵ��ﵽ�յ�ʱ���μ����һ��KMnO4��Һʱ����Һ���dz��ɫ�Ұ�����ڲ���ɫ��
��+2����������������Ʒ�ױ��ʣ����²ⶨ���ƫ�ͣ������Ʒ�к����������ʣ�Ҳ�ܵ��²ⶨ���ƫ�͡�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����1��п�̸ɵ����һ��һ�ε�أ����Ϊ����п���м���̼��������Χ��̼�ۣ��������̣��Ȼ�п���Ȼ�淋���ɵ������õ���ڷŵ���̲���MnOOH��������ˮ�������մ����÷ϵ�ؿ��Եõ����ֻ���ԭ�ϣ��й�������ͼ��ʾ��
�ܽ��/(g/100gˮ)
�¶�/�� ������ | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
������ | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10-17 | 10-17 | 10-39 |
�ش��������⣺
����ͨп�̵�طŵ�ʱ��������Ҫ��ӦΪ��Zn+2NH4Cl+2MnO2��Zn(NH3)2Cl2+2MnOOH���õ���У�����������Ҫ��________��������������Ҫ��Ӧʽ�� ��
�Ӽ������ҺpH��ʹ��Һ������������Ũ�ȴﵽ mol/L�����պ���ȫ����������Ũ��С��1��10-5mol/Lʱ��������Ϊ�����ӳ�����ȫ���������Ӽ����pHΪ ��п��ʼ�������ٶ�Zn2��Ũ��Ϊ0.1mol/L����
��2���ڷ�����ѧ�г���Na2C2O4��������Һ��ɫ����Ϊ�����ʲⶨKMnO4��Һ��Ũ�ȡ���H2SO4��Һ�У���Ӧ���£�2MnO��5C2O��16H��![]() 2Mn2������Һ��ɫ����10CO2����8H2O��
2Mn2������Һ��ɫ����10CO2����8H2O��
������W g Na2C2O4���100 mL����Һ����ȡ20.00 mL������ƿ�У�������KMnO4��ҺӦװ��__________(���ʽ����ʽ��)�ζ����С����εζ� ѡ��ָʾ����������Ҫ����������Ҫ�������жϵζ����յ��������____ ___��
�����ζ�����ʼ�������յ������ͼ��ʾ��������KMnO4�����ʵ���Ũ��Ϊ_ (�����ʽ)��
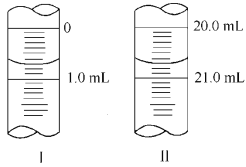
�����ζ���������������ⶨ��KMnO4��Һ��Ũ��___(�ƫ�ߡ�����ƫ�͡����䡱)��





