题目内容
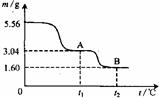
右图是5.56g绿矾(FeSO4·7H2O)隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液,得白色沉淀2.33g。下列说法中正确的有

| A.可用酸性高锰酸钾溶液检验FeSO4溶液是否变质 |
| B.温度为t2时,固体B的化学式为FeO |
| C.在隔绝空气条件下A得到B的化学方程式为 FeSO4  FeO+SO3 FeO+SO3 |
| D.若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为FeO |
D
若FeSO4溶液变质,则溶液中含有Fe3+,因此须鉴定溶液中是否含有Fe3+才能达到实验目的,显然使用酸性高锰酸钾溶液是错误的,宜选KSCN溶液。5.56g绿矾相当于0.02mol,含有0.14mol结晶水共2.52g,当温度为t1时,晶体共失重5.56-3.04=2.52g,正好全部是结晶水的质量,由此可知温度为t1时绿矾完全失水得到FeSO4。根据题意将加热产生的所有气体通入足量的BaCl2溶液,得白色沉淀2.33g,该白色沉淀应为BaSO4,共含有0.01molSO42-,小于绿矾中所含SO42-的物质的量,因此在加热过程中必有SO2气体生成,B点固体的质量1.60g,加热过程中铁元素不会损失,化合物B中氧元素的质量为:1.60-0.02×56=0.48g,相当于0.03mol,因此可得固体B的化学式为Fe2O3,所以A到B发生化学反应的方程式应为2FeSO4
 Fe2O3+SO2↑+SO3↑。同样利用铁元素守恒可得该条件下草酸亚铁热分解的化学方程式为:FeC2O4
Fe2O3+SO2↑+SO3↑。同样利用铁元素守恒可得该条件下草酸亚铁热分解的化学方程式为:FeC2O4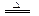 FeO+CO↑+CO2↑,所以本题应选AD。
FeO+CO↑+CO2↑,所以本题应选AD。
练习册系列答案
相关题目

 D:_________________________________。
D:_________________________________。 A:_________________________________。
A:_________________________________。 C(金刚石,s)△H>O,所以金刚石比石墨稳定
C(金刚石,s)△H>O,所以金刚石比石墨稳定 和
和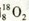 的质子数相同,互为同位素
的质子数相同,互为同位素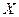 、
、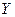 、
、 、
、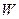 均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它
均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它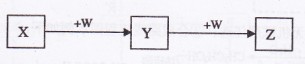
 末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰