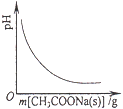
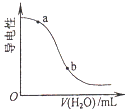
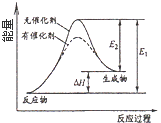
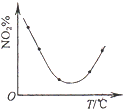
��Ŀ����
����Ŀ����50mL 0.018mol/LAgNO3��Һ�м���50mL 0.02molL��1���ᣮ��֪AgCl��s�����ܶȻ�����Ksp=1��10��10 �� ��Ϻ���Һ������仯���Բ��ƣ�����˵������ȷ���ǣ�������
A.��Ϻ���Һ�п϶��г�������
B.�������ɺ���Һ��Ag+��Ũ��Ϊ1��10��5 molL��1
C.�������ɺ���Һ��pH=2
D.��Ϻ������¶ȣ���Һ��Ag+��Ũ������
���𰸡�B
��������A��n��AgNO3����n��HCl������������ȫ��Ӧ���ɳ���������A��ȷ��
B��c��Cl����=0.01mol/L��c��Ag+��=0.009mol/L����Ӧ��Ӧc��Cl����ʣ��0.001mol/L����Һ��c��Ag+��= ![]() =1��10��7mol/L������B����
=1��10��7mol/L������B����
C���������ɺ�c��H+��= ![]() =0.01mol/L������pH=2������C��ȷ��
=0.01mol/L������pH=2������C��ȷ��
D��AgCl��s�����ܽ�ƽ��Ϊ���ȷ�Ӧ���������¶ȣ�ƽ�������ƶ�����Һ��Ag+��Ũ����������D��ȷ��
����ѡB��

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ