题目内容
【题目】分现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D、C与E分别同主族,D、E、F同周期,B原子的最外层电子数是内层电子数的2.5倍,A与C形成的常见化合物在常温下为液态。
(1)元素A在周期表中的位置是________;D、E、F形成的简单离子中半径最大的是_______(填离子符号)。
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为________。
(3) E与F的最简单气态氢化物中稳定性较强的是________(填化学式)。
(4)元素B和元素F能形成一种化合物BF3,其中F显+1价。BF3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________。
【答案】(1)第一周期I A族;S2-;
(2)Cl2+2NaOH==NaCl+NaClO+H2O
(3)HC1
(4)NC13+4H2O![]() NH3 H2O+3HClO(写“=”也给分)
NH3 H2O+3HClO(写“=”也给分)
【解析】试题分析:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是内层电子数的2.5倍,则B为N元素;A与C形成的常见化合物在常温下为液态,该化合物为水,则A为H元素,C为O元素;A与D、D为Na元素;C与E同主族,E为S元素,则F为Cl元素。
(1)A为H元素,在周期表中位于第一周期I A族;钠离子只有2个电子层,硫离子和氯离子有3个电子层,电子层结构相同的微粒:电子层结构相同(核外电子排布相同)的离子半径(包括阴、阳离子)随核电荷数的增加而减小,种元素形成的简单离子中半径最大的是S2-,故答案为:第一周期I A族;S2-;
(2) 常温下,氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O,故答案为:Cl2+2NaOH==NaCl+NaClO+H2O;
(3)元素的非金属性越强,氢化物的稳定性越强, S与Cl的最简单气态氢化物中稳定性较强的是HC1,故答案为:HC1;
(4) 元素B和元素F能形成一种化合物BF3为NC13,其发生水解反应生成一种弱碱氨水和一种弱酸次氯酸,反应的化学方程式为NC13+4H2O![]() NH3 H2O+3HClO,故答案为:NC13+4H2O
NH3 H2O+3HClO,故答案为:NC13+4H2O![]() NH3 H2O+3HClO。
NH3 H2O+3HClO。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJmol﹣1;
②2A→A﹣A△H=﹣b kJmol﹣1;
③E+A→A﹣E△H=﹣c kJmol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g)△H=﹣a kJmol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
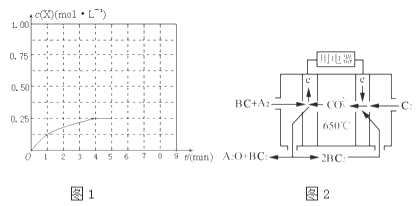
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
【题目】下列除杂质的方法错误的是( )
物质(括号内为杂质) | 除杂方法 | |
A | CO2(O2) | 灼热的铜网 |
B | FeCl2溶液(CuCl2) | 加入过量铁粉,过滤 |
C | CaCl2溶液(盐酸) | 加入过量CaCO3 , 过滤 |
D | CO2(CO) | 通入O2 点燃 |
A.A
B.B
C.C
D.D