题目内容
【题目】常温下,向10.00mL浓度均为0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液中逐滴加入盐酸。利用传感器测得该过程溶液中的阳离子总浓度变化曲线如图;巳知二甲胺在水中电离与氨相似,常温下Kb[(CH3)2NHH2O]=l.60×l0-4。下列说法正确的是( )
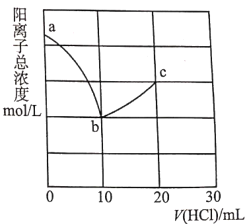
A.a点溶液中,c[(CH3)2NH2+]约为l.60×l0-4mol/L
B.从a到c的过程中,水的电离程度最大的是b点
C.c点溶液中:3c(Na+)+c[(CH3)2NH2+]=2c(Cl-)
D.V(HCl)=15.00mL时,c[(CH3)2NH2+]<c[(CH3)2NHH2O]
【答案】A
【解析】
A. a点溶液为浓度均为0.100molL-1的NaOH溶液和二甲胺[(CH3)2NHH2O]的混合溶液,二甲胺的电离被抑制,则c(OH-)≈0.100molL-1,c[(CH3)2NHH2O] ≈0.100molL-1,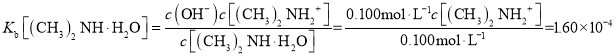 , c[(CH3)2NH2+]≈l.60×l0-4mol/L,A正确;
, c[(CH3)2NH2+]≈l.60×l0-4mol/L,A正确;
B.由图中a到b阳离子总浓度不断降低可知,a到b是盐酸中和氢氧化钠的过程,b点是盐酸和氢氧化钠恰好中和,故可推知HCl的浓度为0.100molL-1,b点为二甲胺和氯化钠的混合溶液,b点因二甲胺的电离呈碱性,水的电离被抑制,b到c是盐酸中和二甲胺的过程,c点二甲胺被恰好中和,其氯化物水溶液因水解呈酸性,故水的电离程度最大的是c点,B错误;
C.c点溶液中,加入HCl的体积为20mL,则溶液中![]() ,
,![]() ;因为水解消耗一部分,故
;因为水解消耗一部分,故![]() ,则3c(Na+)+c[(CH3)2NH2+]≠2c(Cl-),C错误;
,则3c(Na+)+c[(CH3)2NH2+]≠2c(Cl-),C错误;
D.V(HCl)=15.00mL时,二甲胺有一半被中和,(CH3)2NH2Cl和(CH3)2NHH2O 物质的量浓度相等,均为![]() ,常温下Kb[(CH3)2NHH2O]=l.60×l0-4,则溶液中
,常温下Kb[(CH3)2NHH2O]=l.60×l0-4,则溶液中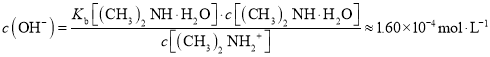 , 溶液呈碱性,即二甲胺的电离程度大于(CH3)2NH2Cl 水解程度,故c[(CH3)2NH2+]>c[(CH3)2NHH2O],D错误;
, 溶液呈碱性,即二甲胺的电离程度大于(CH3)2NH2Cl 水解程度,故c[(CH3)2NH2+]>c[(CH3)2NHH2O],D错误;
答案选A。

【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气泡产生 |
以下结论不正确的是
A.Ⅰ中无明显变化,说明两溶液不反应B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn=ZnCl2+H2↑D.Ⅲ中发生的反应是氧化还原反应