题目内容
有V、W、X、Y、Z五种短周期元素,原子序数依次增大.X是短周期中原子半径最大的主族元素,V的单质常温常压下最轻的气体,V和W可以形成V2W和V2W2两种化合物,W和Z为同主族元素,Y最外层电子数与电子层数相等.
(1)五种元素中按照主族归类,无同一主族元素的是______;
(2)W和X形成原子个数比为1:1的化合物的电子式为______;
(3)已知V有三种常见同位素(zzV、zz+1V、zz+2V),W有常见的两种同位素(a2aW、a2a+2W)则V2W分子有______种,这些分子的相对分子质量有______种不同数值;
(4)Z的单质有Z2、Z4、Z6、Z8等形式,它们之间的关系属于______;
(5)最近日本福岛核电站泄漏的放射性核素铯-137,它的原子序数为55,铯位于元素周期表第______周期第______族;
(6)V、W、X、Z可以形成含有相同四种元素且能相互反应的两种化合物,该反应的离子方程式为______.
(1)五种元素中按照主族归类,无同一主族元素的是______;
(2)W和X形成原子个数比为1:1的化合物的电子式为______;
(3)已知V有三种常见同位素(zzV、zz+1V、zz+2V),W有常见的两种同位素(a2aW、a2a+2W)则V2W分子有______种,这些分子的相对分子质量有______种不同数值;
(4)Z的单质有Z2、Z4、Z6、Z8等形式,它们之间的关系属于______;
(5)最近日本福岛核电站泄漏的放射性核素铯-137,它的原子序数为55,铯位于元素周期表第______周期第______族;
(6)V、W、X、Z可以形成含有相同四种元素且能相互反应的两种化合物,该反应的离子方程式为______.
由X是短周期中原子半径最大的主族元素,则X为钠;V的单质常温常压下最轻的气体,则V为氢;V和W可以形成V2W和V2W2两种化合物,则W为氧;W和Z为同主族元素,则Z为硫;V、W、X、Y、Z五种短周期元素,原子序数依次增大,且Y最外层电子数与电子层数相等,则Y为第三周期第ⅢA族元素,即Y为铝,
(1)V、W、X、Y、Z分别为H、O、Na、Al、S,因H与Na同主族,O与S同主族,只有Al无同一主族元素,故答案为:Y或Al;
(2)W和X形成原子个数比为1:1的化合物为Na2O2,其电子式为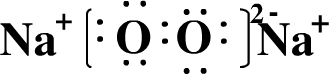 ,
,
故答案为: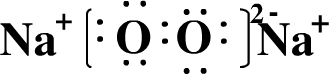 ;
;
(3)H有3种核素,O有2种核素,则V2W分子中有2个H原子和1个O原子,则水有3×2×2=12种,根据相对原子质量计算相对分子质量,存在7种不同的相对分子质量,
故答案为:12;7;
(4)由同种元素组成的不同单质互为同素异形体,故答案为:同素异形体;
(5)Cs的原子序数为55,各层的电子数分别为2、8、18、18、8、1,有6个电子层、最外层电子数为1,则在第六周期第ⅠA族,故答案为:第六周期;ⅠA族;
(6)V、W、X、Z可以形成含有相同四种元素且能相互反应的两种化合物为NaHSO4和NaHSO3,HSO3-为弱酸根离子,
则离子反应为HSO3-+H+=SO2↑+H2O,故答案为:HSO3-+H+=SO2↑+H2O.
(1)V、W、X、Y、Z分别为H、O、Na、Al、S,因H与Na同主族,O与S同主族,只有Al无同一主族元素,故答案为:Y或Al;
(2)W和X形成原子个数比为1:1的化合物为Na2O2,其电子式为
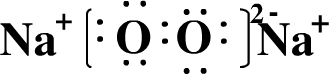 ,
,故答案为:
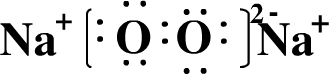 ;
;(3)H有3种核素,O有2种核素,则V2W分子中有2个H原子和1个O原子,则水有3×2×2=12种,根据相对原子质量计算相对分子质量,存在7种不同的相对分子质量,
故答案为:12;7;
(4)由同种元素组成的不同单质互为同素异形体,故答案为:同素异形体;
(5)Cs的原子序数为55,各层的电子数分别为2、8、18、18、8、1,有6个电子层、最外层电子数为1,则在第六周期第ⅠA族,故答案为:第六周期;ⅠA族;
(6)V、W、X、Z可以形成含有相同四种元素且能相互反应的两种化合物为NaHSO4和NaHSO3,HSO3-为弱酸根离子,
则离子反应为HSO3-+H+=SO2↑+H2O,故答案为:HSO3-+H+=SO2↑+H2O.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目