题目内容
【题目】Zn在现代工业中对于电池制造上有不可磨灭的地位,明朝末年宋应星所著的《天工开物》一书中就有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)Zn基态原子的电子排布式为___________,4s能级上的成对电子数为___________。
(2)葡萄糖酸锌{[CH2OH( CHOH)4COO]2Zn}是目前市场上流行的补锌剂。葡萄糖酸锌中碳原子杂化形式有___________,C、H两元素的第一电离能的大小关系为___________________。
(3)ZnCl2与NH3形成的配合物[Zn(NH3)4]Cl2中,存在___________(填字母)。
A离子键 B.σ键 C.π键
(4)锌与某非金属元素X形成的化合物晶胞如图所示,其中Zn和X通过共价键结合,该化合物中Zn与X的原子个数之比为___________。
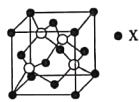
(5)在图示晶胞中若只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___________堆积;设阿伏加德罗常数的数值为NA,该晶胞中Zn的半径为r1nm,X的半径为r2nm,X的相对原子质量为M,则该晶体的密度为___________g·cm-3(用含r1、r2、M、NA的代数式表示)。
【答案】1s22s22p63s23p63d104s2或[Ar] 3d104s2 2 sp2、sp3 C<H AB 1:1 面心立方最密 ![]()
【解析】
(1)Zn原子核外电子数为30,其核外电子排布式为:1s22s22p63s23p63d104s2或[Ar] 3d104s2;
4s能级上只有2个电子且成对,故成对电子数为2;
(2)葡萄糖酸锌里有两种碳原子,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(—COO-里的碳);
第一电离能表示气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,由于H的电子层数少、原子半径最小,原子核对外层电子的引力较强,故第一电离能C<H;
(3) 配合物[Zn(NH3)4]Cl2中[Zn(NH3)4]2+与氯离子形成离子键,Zn2+与NH3之间形成σ键, NH3中氮原子与氢原子之间形成σ键,答案选AB;
(4)根据均摊法计算,晶胞中锌的个数为4个,X的个数为8×![]() +6×
+6×![]() =4,该化合物中Zn与X的原子个数之比为1:1;
=4,该化合物中Zn与X的原子个数之比为1:1;
(5)根据晶胞结构特点可知,X的堆积方式属于金属晶体堆积方式中的面心立方最密堆积;设晶胞得边长是a,则根据晶胞结构可知![]() a=(4r1+4r2)nm,解得a=
a=(4r1+4r2)nm,解得a=![]() nm,则根据
nm,则根据![]() ×NA=4,解得ρ=
×NA=4,解得ρ=![]() g·cm-3。
g·cm-3。

 发散思维新课堂系列答案
发散思维新课堂系列答案




