题目内容
(8分)一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)所得溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)所得的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是 ,肯定含有的离子是 ,不能确定是否含有的离子是 ,可通过 (填实验方法)来进一步确定该离子。
【答案】
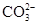 、
、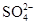 ;
;
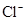 、Al3+、
、Al3+、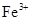 ;
;
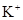 ;
焰色反应
;
焰色反应
【解析】根据(1)可知气体放出,说明没有CO32-。由(2)可知有色沉淀应该是氢氧化铁沉淀,即一定含有铁离子。滤液中加入硝酸酸化的硝酸银生成沉淀,说明一定含有氯离子。根据(3)可知沉淀中没有硫酸钡,说明一定没有SO42-。根据(5)可判断,沉淀中含有氢氧化铝,说明一定还含有铝离子。根据以上分析可知钾离子是无法确定的,需要透过焰色反应进一步确定。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目