题目内容
常温下,有下列四种溶液:
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为: c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为: c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D
试题分析:氢氧化钠是一元强碱,醋酸是一元弱酸,在浓度相同的条件下,氢氧化钠抑制水的电离程度大,即由水电离出的c(H+):①<③,A不正确;醋酸是弱酸,所以③稀释到原来的100倍后,pH>3,B不正确;①与③混合,如果二者恰好反应,则溶液显碱性。若溶液pH=7,则说明醋酸是过量的,因此V(NaOH) <V(CH3COOH),C不正确;D中醋酸过量时,可以出现该情况,因此正确的答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,灵活性强,注重考查学生分析问题、解决问题的能力,有助于培养学生严谨的逻辑思维能力和发散思维能力。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
 H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是 不变
不变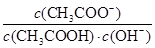 不变
不变 NH4++ NH2- , 据此判断以下叙述错误的是
NH4++ NH2- , 据此判断以下叙述错误的是  NH4+ + OH– 当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是
NH4+ + OH– 当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是 
 H+(溶液)+ In-(黄色溶液)
H+(溶液)+ In-(黄色溶液)