题目内容
【题目】实验室里研究不同价态硫元素之间的转化
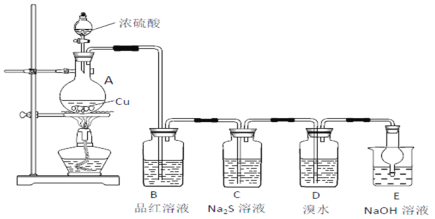
(1)A中发生反应的化学方程式为________________。
(2)B中的现象是__________________。
(3)C中出现淡黄色沉淀,反应中Na2S做____________(填“氧化剂”或“还原剂”)。
(4)D溴水褪色,该反应S元素的价态变化是由+4价变为________________价。
(5)E的作用是_____________,离子方程式为_________________________。
(6)上述实验D体现SO2的性质是_________________。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 品红褪色 还原剂 +6 吸收SO2尾气,防止污染环境 SO2+2OH=
CuSO4+SO2↑+2H2O 品红褪色 还原剂 +6 吸收SO2尾气,防止污染环境 SO2+2OH=![]() +H2O 还原性
+H2O 还原性
【解析】
装置A中浓硫酸与Cu在加热条件反应生成SO2,B中品红溶液可以检验二氧化硫的漂白性,C中硫化钠可以和二氧化硫发生归中反应生成S单质,从而验证二氧化硫的还原性,D中溴水具有较强氧化性,可以将二氧化硫氧化成硫酸根,溴被还原从而溴水褪色,E中NaOH溶液可以吸收未反应的二氧化硫。
(1)浓硫酸具有强氧化性,加热条件可以将Cu氧化,自身被还原生成二氧化硫,结合电子守恒和元素守恒可得化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性可以使品红溶液褪色,所以现象为品红褪色;
(3)C中出现淡黄色沉淀说明生成S单质,硫化钠和二氧化硫发生归中反应,硫化钠中硫元素化合价升高,所以硫化钠作还原剂;
(4)溴水具有氧化性可以将+4价的硫氧化,根据硫的价态变化规律可知被氧化成+6价;
(5)二氧化硫会污染空气不能直接排放,可用NaOH溶液吸收,离子方程式为SO2+2OH=![]() +H2O;
+H2O;
(6)D中二氧化硫被氧化,体现了二氧化硫的还原性。

【题目】下述实验不能达到预期实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 将 | 配制质量分数为 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 将少量某有机物滴加到新制氢氧化铜悬浊液中,观察是否有红色沉淀生成 | 检验该有机物中是否含有醛基 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的 | 研究浓度对反应速率的影响 |
A.AB.BC.CD.D