题目内容
4.常温下,下列溶液中各微粒浓度关系或pH判定不正确的是( )| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 moL/L NaOH溶液充分混合,若混合后溶液的体积为10mL,則混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-4mol/L,若a>7,則pH-定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
分析 A.先计算混合溶液中氢离子浓度,再根据混合溶液中氢离子浓度计算溶液的pH;
B.酸或碱都抑制水电离,含有弱根离子的盐促进水电离;
C.酸的酸性越小,酸电离程度越小,则酸根离子水解程度越大,pH相等的不同钠盐,酸根离子水解程度越大的其溶液浓度越小;
D.任何电解质溶液中都存在电荷守恒.
解答 解:A.混合溶液中c(H+)=$\frac{(0.02mol/L×2-0.02mol/L)×0.005L}{0.01L}$=10-2mol/L,则溶液的pH=2,故A正确;
B.某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,该物质可能是酸或碱,如果是酸,则pH=14-a,如果是碱,则pH=a,故B错误;
C.酸的电离程度大小顺序是①CH3COOH>②C6H5OH>③HCO3-,酸的电离程度越大,其酸根离子水解程度越小,pH相等的钠盐溶液中其浓度越大,所以pH相等的①CH3COONa、②C6H5ONa、③NaHCO3溶液中,钠盐浓度大小顺序是:①>③>②,故C正确;
D.硝酸钾是强酸强碱盐,根据物料守恒知,c(K+)=c(NO3-),溶液中存在电荷守恒:c(Na+)+c(H+)+c(K+)=c(NO3-)+c(CH3COO-)+c(OH-),二者结合可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正确;
故选B.
点评 本题考查了酸碱混合溶液定性判断、离子浓度大小的比较,题目难度中等,明确物质的性质是解本题关键,结合电荷守恒和物料守恒来分析解答,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
14.下列元素中,属于短周期ⅦA族的是( )
| A. | F | B. | Br | C. | I | D. | Be |
12.下列实验装置图,其中关于用途的描述,不正确的是( )
| A. |  装置:收集二氧化碳,从a口进气b口排气 | |
| B. | 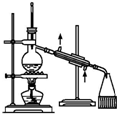 装置:用于石油的分馏 | |
| C. | 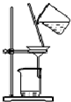 装置:用于分离Cl2与KI溶液反应生成的碘 | |
| D. | 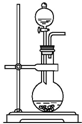 装置:可用来制取氨气 |
19.常温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3.H2O)=1×10-4mol•L-1 | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-1) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①=② |
9.伞形酮可用作荧光指示剂和酸碱指示剂,其合成方法如图所示,下列有关这三种物质的说法正确的是( )


| A. | 雷琐苯乙酮所有碳原子不可能共平面 | |
| B. | 雷琐苯乙酮、伞形酮能用酸性KmnO4鉴别 | |
| C. | 1mol雷琐苯乙酮跟足量H2反应,最多消耗3molH2 | |
| D. | 1mol伞形酮与足量NaOH溶液反应,最多消耗3molNaOH |
16.下列有关物质的性质与应用相对的是( )
| A. | PbO2具有氧化性和导电性,故可作为铅蓄电池的负极材料 | |
| B. | 炭具有还原性,一定条件下能 将二氧化硅还原为硅 | |
| C. | 酒精能使蛋白质溶液沉淀析出,可以用来分离提纯蛋白质溶液 | |
| D. | Al的金属较强,可用作飞机火箭的结构材料 |


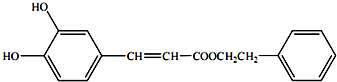
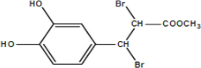
 (或
(或 、
、 )
) .
.