题目内容
下列说法不正确的是( )
| A、氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个 |
| B、分子晶体中有范德华力,也有共价键 |
| C、干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个 |
| D、晶体熔点:晶体硅<SiC |
考点:不同晶体的结构微粒及微粒间作用力的区别,晶体的类型与物质熔点、硬度、导电性等的关系
专题:化学键与晶体结构
分析:A、根据氯化钠的晶胞图分析;
B、单原子分子形成的晶体中没有共价键;
C、根据二氧化碳的晶胞图分析;
D、原子晶体的共价键键能越强,则晶体的熔点越高.
B、单原子分子形成的晶体中没有共价键;
C、根据二氧化碳的晶胞图分析;
D、原子晶体的共价键键能越强,则晶体的熔点越高.
解答:
解:A、氯化钠的晶胞图为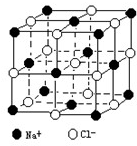 ,则氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个,故A正确;
,则氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个,故A正确;
B、单原子分子形成的晶体中没有共价键,如稀有气体为单原子分子,晶体中没有共价键,故B错误;
C、二氧化碳的晶胞图为 ,则干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个,故C正确;
,则干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个,故C正确;
D、原子晶体中原子半径越小,共价键键长越短,则共价键键能越强,其晶体的熔点越高,半径:C<Si,则晶体熔点:晶体硅<SiC,故D正确.
故选B.
 ,则氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个,故A正确;
,则氯化钠晶体中,每个Cl-周围最近且距离相等的Cl-共有12个,故A正确;B、单原子分子形成的晶体中没有共价键,如稀有气体为单原子分子,晶体中没有共价键,故B错误;
C、二氧化碳的晶胞图为
 ,则干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个,故C正确;
,则干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个,故C正确;D、原子晶体中原子半径越小,共价键键长越短,则共价键键能越强,其晶体的熔点越高,半径:C<Si,则晶体熔点:晶体硅<SiC,故D正确.
故选B.
点评:本题考查了晶体结构、共价键、晶体的熔点比较,题目难度不大,注意掌握常见晶体的晶胞图的理解和分析.

练习册系列答案
相关题目
下列离子方程式中,正确的是( )
| A、向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| B、金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ |
| C、铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ |
| D、氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
氧氟沙星是常用抗菌药,其结构简式为:

下列对氧氟沙星叙述错误的是( )

下列对氧氟沙星叙述错误的是( )
| A、能发生加成、取代反应 |
| B、能发生还原、酯化反应 |
| C、分子内共有19个氢原子 |
| D、分子内共平面的碳原子多于6个 |
实验室用铁片与稀H2SO4(1mol/L)反应制取H2时,采取下列措施,不能使生成H2的速率加快的是( )
| A、将铁片改为铁粉 |
| B、滴加少量CuSO4溶液 |
| C、给试管内混合物加热 |
| D、将稀H2SO4改为浓H2SO4 |
下列各组物质既不是同系物又不是同分异构体的是( )
| A、果糖和蔗糖 |
| B、甲酸甲酯和乙酸 |
| C、对甲基苯酚和苯甲醇 |
| D、乙二醇和丙二醇 |
不属于氧化还原反应的是( )
A、N2+3H2
| ||||
B、SiO2+CaO
| ||||
C、2Al+Fe2O3
| ||||
D、2Mg+CO2
|
下列各组离子可以在溶液中大量共存的是( )
| A、Na+、Ba2+、NO3-、SO42- |
| B、NH4+、K+、Cl-、OH- |
| C、K+、H+、NO3-、HCO3- |
| D、K+、OH-、Cl-、AlO2- |