题目内容
15.下列关于氯水的叙述,不正确的是( )| A. | 氯水应保存在棕色瓶中,久置的氯水,pH值减小 | |
| B. | 新制饱和氯水中存在4个平衡 | |
| C. | 在一定浓度的氯水中加小苏打,$\frac{c(HClO)}{c(C{l}^{-})}$变小 | |
| D. | 饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法 |
分析 氯水中,氯气与水发生Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,氯水具有酸性和强氧化性,其中HClO见光易分解而变质,以此解答.
解答 解:A.氯水中的次氯酸见光易分解,生成HCl和O2,酸性增强,pH减小,所有要保持在棕色瓶中,故A正确;
B.氯水中存在H2O?H++OH-,Cl2+H2O?HCl+HClO,HClO?H++ClO-三个平衡状态,故B错误;
C.氯水中含有一定量浓度的盐酸,能与小苏打生成CO2气体,所以平衡Cl2+H2O?HCl+HClO正向移动,但两者物质的量是按1:1增加,所以$\frac{c(HClO)}{c(C{l}^{-})}$不变,故C错误;
D.氯水中存在平衡:Cl2+H2O?HCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,故D正确.
故选BC.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.

练习册系列答案
相关题目
5.下列物质所属类别不正确的是( )
| A. | 氯化铝--盐 | B. | 纯碱--碱 | C. | 金属钠--单质 | D. | 胆矾--纯净物 |
6.下列有关物质用途的叙述错误的是( )
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 煤的气化和液化主要是生成清洁燃料,煤的干馏主要是生产化工原料 |
3.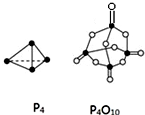 参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
 参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )| 化学键 | Si-O | O=O | Si-Si | P-P | P-O | P=O | O=O |
| 键能kJ•mol-1 | 460 | 498.8 | 176 | a | b | c | d |
| A. | -61.2 kJ•mol-1、(4c+12b-4a-5d)kJ•mol-1 | |
| B. | -989.2 kJ•mol-1、(4c+12b-6a-5d)kJ•mol-1 | |
| C. | -989.2 kJ•mol-1、(6a+5d-4c-12b)kJ•mol-1 | |
| D. | -245.2 kJ•mol-1、(4a+5d-4c-12b)kJ•mol-1 |
10.要求设计实验证明:某种盐的水解是吸热的.有四位同学分别设计如下方案,其中不正确的是( )
| A. | 甲同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解是吸热的 | |
| B. | 乙同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸 钠水解是吸热的 | |
| D. | 丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸气)后若红色加深,说明醋酸钠水解是吸热的 |
20.下列溶液中一定能大量共存的离子组是( )
| A. | Mg2+、K+、NO3-、OH- | B. | Ba2+、NH4+、NO3-、OH- | ||
| C. | Ca2+、K+、SO42-、Cl- | D. | Ba2+、Na+、Cl-、NO3- |
7.下列微粒电子式错误的是( )
| A. | 氯原子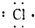 | B. | 硫离子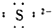 | C. | 溴离子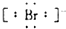 | D. | 钙离子Ca2+ |

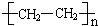 .
. .
.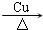 2CH3CHO+2H2O.
2CH3CHO+2H2O. .
.