题目内容
对于可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡状态时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2v正(NH3)=3v正(H2O)
【答案】
A
【解析】根据反应方程式有4v正(O2)=5v正(NO),故4v正(O2)=5v逆(NO)表示v正(NO)=v逆(NO),所以A项正确。生成NO和消耗NH3均为正反应的变化,叙述中未提及逆反应的情况,所以B项错误。由于反应物、生成物均为气体,故增大容器容积正、逆反应速率都减小,所以C项错误。在反应的任意状态总有v正(NH3)∶v正(H2O)=2∶3,即3v正(NH3)=2v正(H2O),所以D项错误。答案为A。

练习册系列答案
相关题目
 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)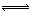 4NO(g)+6H2O(g)下列叙述正确的是( )。
4NO(g)+6H2O(g)下列叙述正确的是( )。