题目内容
如下所示,A、B、C三个装置中的三个烧杯分别盛有足量的 CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是_________(填标号,下同),属于电解池的是_________。
(2)A池中Zn是____________极,发生____________ (填“氧化”或“还原”,下同)反应,电极反应式为____________________________;Cu是____________极,发生____________反应,电极反应式为_____________________;A中总反应的化学方程式为______________________。
(3)B池中C是____________极,发生____________反应,电极反应式为________________;Pt是____________极,发生____________反应,电极反应式为________________________; B中总反应的化学方程式为________________________。
(4)C池中 Zn是____________极,发生____________反应,电极反应式为______________;Cu是____________极,发生______________反应,电极反应式为______________;反应过程中溶液的浓度____________(填“变大”“变小”或“不变”)。
解析:判断装置是原电池还是电解池,关键是看它有没有外接直流电源,有则为电解池,无则为原电池。由此可知A为原电池,B和C为电解池。原电池中电极分为正极、负极,相对活泼的金属作负极失去电子发生氧化反应,相对不活泼的金属作正极。所以 A中Zn作负极失去电子被氧化,发生反应为Zn-2e-![]() Zn2+;Cu为正极,电解液中阳离子在正极上得电子被还原,发生反应为 Cu2++2e-
Zn2+;Cu为正极,电解液中阳离子在正极上得电子被还原,发生反应为 Cu2++2e-![]() Cu。 A池中总反应为上述两个半反应的和,即 Zn+Cu2+
Cu。 A池中总反应为上述两个半反应的和,即 Zn+Cu2+![]() Cu+Zn2+。
Cu+Zn2+。
电解池中规定与直流电源负极相连的电极为阴极,与直流电源正极相连的电极为阳极。在外电场的作用下,溶液中的 H+和 Cu2+均移向阴极,但因盐溶液中阳离子得电子能力 Cu2+> H+,因而发生还原反应 Cu2++2e-![]() Cu。同时溶液中失电子能力较强的 Cl-在阳极Pt表面被氧化,电极反应为 2Cl--2e-
Cu。同时溶液中失电子能力较强的 Cl-在阳极Pt表面被氧化,电极反应为 2Cl--2e-![]() Cl2↑。总反应的化学方程式为 CuCl2
Cl2↑。总反应的化学方程式为 CuCl2![]() Cu+Cl2↑。
Cu+Cl2↑。
装置C中阳极为活性电极,当阳极不是惰性电极时,电极本身会被强迫失电子而发生氧化反应Cu-2e-![]() Cu2+,生成离子进入溶液,此时溶液中阴离子不能失电子。而阴极上发生还原反应 Cu2++2e-
Cu2+,生成离子进入溶液,此时溶液中阴离子不能失电子。而阴极上发生还原反应 Cu2++2e-![]() Cu,两极反应速率相等,溶液中其他离子不发生反应,故溶液浓度保持不变。
Cu,两极反应速率相等,溶液中其他离子不发生反应,故溶液浓度保持不变。
答案: (1) A BC
(2)负 氧化 Zn-2e-![]() Zn2+ 正 还原 Cu2++2e-
Zn2+ 正 还原 Cu2++2e-![]() Cu Zn+Cu2+
Cu Zn+Cu2+![]() Cu+Zn2+
Cu+Zn2+
(3)阴 还原 Cu2++2e-![]() Cu 阳 氧化 2Cl--2e-
Cu 阳 氧化 2Cl--2e-![]() Cl2↑ CuCl2
Cl2↑ CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
(4)阴 还原 Cu2++2e-![]() Cu 阳 氧化 Cu-2e-
Cu 阳 氧化 Cu-2e-![]() Cu2+ 不变
Cu2+ 不变

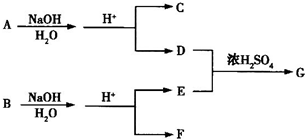
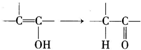
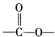 基团.
基团.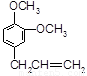 B.
B.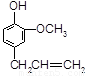 C.
C.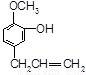 D.
D. E.
E.
 B.
B.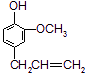 C.
C.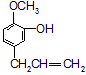 D.
D. E.
E.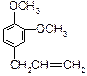 B.
B. C.
C.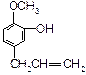 D.
D. E.
E.