题目内容
(2012?昆明模拟)火力发电厂释放出的大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃烧废气进行脱硝、脱碳和脱硫等处理,可实验绿色环保、节能减排、废物利用.
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳:将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)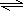 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
T℃时,取2mol CO2和4mol H2混合,加入到1L恒容密闭容器中,发生上述反应,10分钟后达到平衡时测得甲醇的体积分数为25%,计算氢气的转化率
(3)脱硫:某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物.设烟气中SO2、NO2的物质的量为1:1,写出该反应的化学方程式(不要求配平)
(1)脱硝:利用甲烷催化还原NOx;
CH4(g)+4NO2(g)=CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
.(2)脱碳:将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
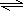 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0T℃时,取2mol CO2和4mol H2混合,加入到1L恒容密闭容器中,发生上述反应,10分钟后达到平衡时测得甲醇的体积分数为25%,计算氢气的转化率
75%
75%
.T℃时该反应的化学平衡常数K=1
1
;升高温度,K减小
减小
.(选填“增大”“减小”“不变”)(3)脱硫:某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物.设烟气中SO2、NO2的物质的量为1:1,写出该反应的化学方程式(不要求配平)
NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
.将生成的硫酸铵和硝酸铵的混合物溶解于水,室温下测得溶液的pH小于7,其原因是NH4++H2O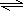 NH3?H2O+H+
NH3?H2O+H+
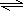 NH3?H2O+H+
NH3?H2O+H+NH4++H2O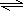 NH3?H2O+H+
NH3?H2O+H+
.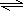 NH3?H2O+H+
NH3?H2O+H+分析:(1)根据盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
(2)根据化学平衡计算三步曲,求出参加反应氢气的物质的量,计算氢气的转化率;根据化学平衡常数概念,代入数据,求出常数;根据温度对对化学平衡的影响.
(3)根据题目信息,抓住质量守恒,写出化学方程式;考虑盐类的水解.
(2)根据化学平衡计算三步曲,求出参加反应氢气的物质的量,计算氢气的转化率;根据化学平衡常数概念,代入数据,求出常数;根据温度对对化学平衡的影响.
(3)根据题目信息,抓住质量守恒,写出化学方程式;考虑盐类的水解.
解答:解:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
(2)CO2(g)+3H2(g)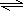 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0
起始(mol) 2 4 0 0
反应(mol) X 3X X X
10分钟后(mol) 2-X 4-3X X X
甲醇的体积分数为
×100%=25% 可得:X=1
所以氢气的转化率为:
×100%=75%,
平衡常数K=
=
=1
升高温度,平衡向吸热的方向移动,即逆向移动,K减小.
故答案为:75%;1;减小;
(3)由题目信息可知反应为NH3、O2、SO2、NO2、H2O,生成物为(NH4)2SO4、NH4NO3,
由此可写出方程式为NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,
故答案为:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
(4)因铵盐要发生水解:NH4++H2O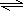 NH3?H2O+H+,故答案为:NH4++H2O
NH3?H2O+H+,故答案为:NH4++H2O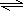 NH3?H2O+H+
NH3?H2O+H+
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
故答案为:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ/mol
(2)CO2(g)+3H2(g)
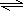 CH3OH(g)+H2O(g)△H<0
CH3OH(g)+H2O(g)△H<0起始(mol) 2 4 0 0
反应(mol) X 3X X X
10分钟后(mol) 2-X 4-3X X X
甲醇的体积分数为
| X |
| 2-X+4-3X+X+X |
所以氢气的转化率为:
| 3 |
| 4 |
平衡常数K=
| C(CH3OH)C(H2O) |
| C(CO2)C3( H2) |
| 1×1 |
| 1×1 |
升高温度,平衡向吸热的方向移动,即逆向移动,K减小.
故答案为:75%;1;减小;
(3)由题目信息可知反应为NH3、O2、SO2、NO2、H2O,生成物为(NH4)2SO4、NH4NO3,
由此可写出方程式为NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,
故答案为:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3
(4)因铵盐要发生水解:NH4++H2O
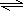 NH3?H2O+H+,故答案为:NH4++H2O
NH3?H2O+H+,故答案为:NH4++H2O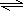 NH3?H2O+H+
NH3?H2O+H+点评:本题从多个角度对化石燃料进行了全面的考查,培养了学生分析问题的能力.

练习册系列答案
相关题目
 NH3.H2O
NH3.H2O NH4++OH-,有关叙述正确的是( )
NH4++OH-,有关叙述正确的是( )