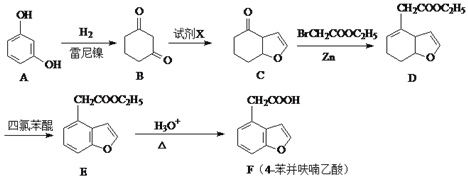
题目内容
【题目】乙醇是重要的有机化工原料,也是优质的燃料,工业上可由乙烯水合法或发酵法生产。回答下列问题:
(1)乙烯水合法可分为两步
第一步:反应CH2=CH2+ HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙醋);
第二步:硫酸氢乙酯水解生成乙醇。
① 第一步属于反应____________________(填反应类型)。
② 第二步反应的化学方程式为__________________________________。
③ 上述整个过程中浓硫酸的作用是___________________________________。
(2)发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇
植物秸秆—水解→C6H12O6—酒化酶→2CH3CH2OH+2CO2↑
![]()
纤维素的化学式为_______________,现要制取4.6 吨乙醇,至少需要植物秸秆________吨。
(3)乙醇汽油是用90%的普通汽油与10 %的燃料乙醇调和而成。乙醇汽油中乙醇是可再生能源,来源于_______________(填“乙烯水合法”或“发酵法”)。
(4)以乙醇为原料可制备某种高分子涂料,其转化关系如下图:

① 有机物A 的结构简式为____________。
② 反应Ⅱ的化学方程式为_____________________________。
【答案】 加成 CH3CH2OSO3H + H2O ![]() CH3CH2OH + H2SO4 催化剂 (C6H10O5)n 8.1 发酵法 CH2=CHCOOH nCH2=CHCOOC2H5
CH3CH2OH + H2SO4 催化剂 (C6H10O5)n 8.1 发酵法 CH2=CHCOOH nCH2=CHCOOC2H5![]()
![]()
【解析】(1)① 第一步CH2=CH2+ HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙醋),属于加成反应;② 第二步反应硫酸氢乙酯水解生成乙醇,同时生成硫酸,其化学方程式为:CH3CH2OSO3H + H2O ![]() CH3CH2OH + H2SO4;③ 上述整个过程中浓硫酸参与反应,但反应前后质量和化学性质不变,其作用是催化剂;(2)纤维素的化学式为(C6H10O5)n,根据反应C6H12O6—酒化酶→2CH3CH2OH+2CO2↑可知(C6H10O5)n
CH3CH2OH + H2SO4;③ 上述整个过程中浓硫酸参与反应,但反应前后质量和化学性质不变,其作用是催化剂;(2)纤维素的化学式为(C6H10O5)n,根据反应C6H12O6—酒化酶→2CH3CH2OH+2CO2↑可知(C6H10O5)n![]() nC6H12O6
nC6H12O6![]() 2nCH3CH2OH,要制取4.6 吨乙醇,至少需要植物秸秆
2nCH3CH2OH,要制取4.6 吨乙醇,至少需要植物秸秆![]() =8.1吨;(3)乙醇汽油中乙醇是可再生能源,来源于发酵法;(4)①根据反应Ⅰ可知,乙醇与有机物A在浓硫酸作用下发生酯化反应生成丙烯酸乙酯,则有机物A为丙烯酸,其结构简式为:CH2=CHCOOH;② 反应Ⅱ为丙烯酸乙酯发生加聚反应生成聚丙烯酸乙酯,其反应的化学方程式为nCH2=CHCOOC2H5
=8.1吨;(3)乙醇汽油中乙醇是可再生能源,来源于发酵法;(4)①根据反应Ⅰ可知,乙醇与有机物A在浓硫酸作用下发生酯化反应生成丙烯酸乙酯,则有机物A为丙烯酸,其结构简式为:CH2=CHCOOH;② 反应Ⅱ为丙烯酸乙酯发生加聚反应生成聚丙烯酸乙酯,其反应的化学方程式为nCH2=CHCOOC2H5![]()
![]() 。
。

【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
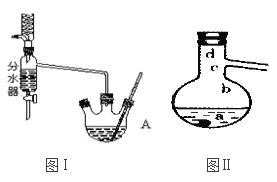
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL乙酸(过量),0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(1)仪器A的名称是_________,使用分水器(实验中可分离出水)能提高酯的产率,其原因是______________________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),用Na2CO3溶液洗涤的目的是____________,试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①蒸馏过程中需要使用_________形冷凝管,当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶的先后顺序是___________。(填“先a后b"或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。