题目内容
在100mL混合溶液中,HNO3和H2SO4物质的量浓度分别为0.4mol?L-1和0.1mol?L-1,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中Cu2+物质的量浓度(mol?L-1)为( )
分析:铜屑投入HNO3和H2SO4的混合溶液中发生的反应实质为硫酸提供氢离子硝酸根离子具有强氧化性继续反应,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,根据反应的量来确定消耗的铜以及生成气体的量,生成铜离子的物质的量分析判断.
解答:解:应实质为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,1.92g铜粉物质的量=
=0.03mol,100mL混合溶液中,HNO3和H2SO4物质的量浓度分别为0.4mol?L-1和0.1mol?L-1,所含氢离子物质的量=0.1L×0.4mol/L+0.1L×0.1mol/L×2=0.06mol,依据反应离子方程式可知铜剩余,根据氢离子物质的量甲酸生成铜离子物质的量为8H+~3Cu2+,得到铜离子物质的量为0.0225mol,所得溶液中Cu2+物质的量浓度为0.225mol/L;
故选:B.
| 1.92g |
| 64g/mol |
故选:B.
点评:本题考查了硝酸的性质应用,主要是硝酸根离子在酸性溶液中的氧化性判断,化学反应的实质,过量计算的应用.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
在100mL混合溶液中,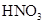 和
和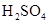 物质的量浓度分别为
物质的量浓度分别为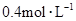 和
和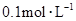 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中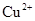 物质的量浓度(
物质的量浓度(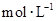 )为
)为
| A.0.15 | B.0.225 | C.0.35 | D.0.45 |