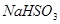题目内容
(11分)某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据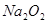 和
和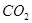 的反应,用类比的方法推理
的反应,用类比的方法推理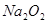 与
与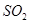 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据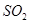 的强还原性和
的强还原性和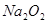 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有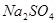 。为检验生成物中是否存在
。为检验生成物中是否存在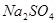 ,他们设计了如下实验方案:
,他们设计了如下实验方案:
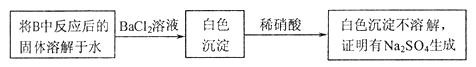
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向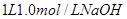 溶液中缓慢通入
溶液中缓慢通入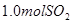 气体,请分析通入
气体,请分析通入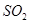 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。
|
|
溶液中溶质的化学式 |
|
(0,0.5) |
__________ |
|
__________ |
|
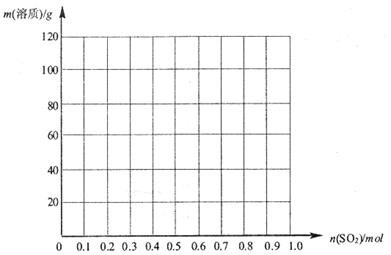
请在下图中画出溶液中溶质的总质量随缓慢通入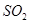 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
(1)干燥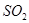 (1分)
(1分)
(2)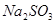 (1分);不合理(1分),
(1分);不合理(1分),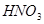 可将
可将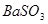 氧化为
氧化为 或过量的
或过量的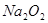 可将
可将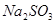 氧化为
氧化为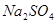 (1分)
(1分)
(3)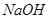 和
和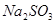 (2分);(0.5,1.0)(2分)
(2分);(0.5,1.0)(2分)
【解析】(1)由于SO2中含有水蒸气,而水也能和过氧化钠反应,所以浓硫酸的作用是干燥SO2。
(2)过氧化钠和CO2的生成物是碳酸钠和氧气,据此类推SO2和过氧化钠反应的固体生成物应该是Na2SO3。由于稀硝酸具有氧化性,能把BaSO3氧化生成BaSO4,其次过量的过氧化钠也能把Na2SO3氧化生成Na2SO4,因此是不合理的。
(3)氢氧化钠和SO2反应的方程式为2NaOH+SO2=Na2SO3+H2O、NaOH+SO2=NaHSO3。因此根据方程式可知,如果SO2的物质的量小于0.5mol,则溶液中的溶质就是NaOH和Na2SO3;如果SO2恰好是0.5mol,则溶质只有Na2SO3;如果SO2的物质的量大于0.5mol,而小于1.0mol,则溶质是Na2SO3和NaHSO3;如果SO2恰好是1mol,则溶质只有NaHSO3。由于氢氧化钠和SO2都是1mol,所以氢氧化钠是40g,最多生成亚硫酸钠是63g,亚磷酸氢钠是104g,图像见答案。

(16分)某实验小组用浓盐酸和MnO2制取并探究Cl2化学性质,设计装置图如下图所示:

A B C D
(1)A是氯气发生装置(省略未画),制备Cl2的化学反应离子方程式是 ,A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有 。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为
。
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探
究该条件下不能生成氯气的原因。
①提出合理假设
假设1:H+的浓度不够大;
假设2: ;
假设3:_________________________ _ 。
②设计实验方案,进行实验。在答题卷上写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1mol/L稀盐酸、1mol/LAgNO3溶液、淀粉-KI溶液
|
实验步骤 |
预期现象与结论 |
|
步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,
。 |
|
|
步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,
。 |
|
 的范围
的范围
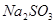 、
、