题目内容
9.关于第三周期元素性质的说法正确的是( )| A. | 镁单质能和冷水发生剧烈的反应 | B. | 碱性Mg(OH)2<Al(OH)3 | ||
| C. | 稳定性SiH4<HCl | D. | 金属性Na<Mg |
分析 A.金属性越强,与水反应越剧烈;
B.金属性越强,对应碱的碱性越强;
C.非金属性越强,对应氢化物越稳定;
D.同周期从左向右金属性减弱.
解答 解:A.金属性越强,与水反应越剧烈,Na与冷水反应,而Mg不能与冷水剧烈反应,故A错误;
B.金属性Mg>Al,对应碱的碱性为Mg(OH)2>Al(OH)3,故B错误;
C.非金属性Cl>Si,对应氢化物的稳定性为SiH4<HCl,故C正确;
D.同周期从左向右金属性减弱,则金属性Na>Mg,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
19.标准状况下,11.2LCO2中所含的CO2分子数为( )
| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 0.25 |
20.下列实验事实不能作为实验判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量氨水,判断Mg与Al的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2气体,判断碳与硅的非金属性强弱 | |
| D. | Br2与I2分别与足量H2反应,判断溴与碘的非金属性强弱 |
17.已知反应物的总能量低于产物的总能量,则反应是( )
| A. | 放热反应 | B. | 吸热反应 | C. | 有催化剂作用 | D. | 无法判断 |
14.如图是滴定管和量筒的两个液面.下列有关读数中正确的是( )
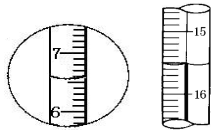

| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
1. 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )
 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2,下列有关说法正确的是( )| A. | 反应开始2min内,v(A)=0.025mol/(L•mol) | |
| B. | t1时改变的条件可能是升高温度 | |
| C. | t3时改变的条件可能是加压,此时c(B)不变 | |
| D. | t4时可能是使用了催化剂,此时c(B)不变 |
12.同温同压下,等体积的两容器内分别充满NO和CO气体,下列对两容器中气体的判断正确的是( )
| A. | 分子数不同 | B. | 质子数相同 | C. | 氧原子数相同 | D. | 气体质量相同 |
