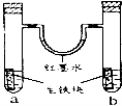
��Ŀ����
����Ŀ������ͼ�У�E��F�ֱ�Ϊ��Դ���������ձ���ʢ��100 mL 0.2mol��L��1 AgNO3��Һ�����ձ���ʢ��100 mL 0.15 mol��L��1 CuCl2��Һ��A��B��C��D��Ϊʯī�缫��������һ��ʱ�����B������1.08g����

��1��EΪ________����
��2��A���ĵ缫��ӦʽΪ___________����������________mL��(��״��)
��3�������ձ���Һ������䣬���ʱ��Һ�����ʵ���Ũ�Ƚ���Ϊ mol��L��1��
��4�����ձ��е���ʯ����Һ��________��������죨��A��B�������������⣬�ڼ��ձ������յõ�________��Һ(�����ʵĻ�ѧʽ)��
���𰸡���1���� ��2��4OH����4e��===2H2O��O2�� 56
��3��0.1 ��4��A HNO3
��������
���������(1)���ձ���B�����أ�˵��B����Ag��������B������������A��������E�ǵ�Դ��������F�ǵ�Դ�ĸ�����D�ǵ��ص�������C�ǵ��ص�����;
(2)���ձ��ǵ����������Һ������A�������������ӷŵ������������缫��ӦʽΪ4OH--4e-===2H2O+O2��;B������1.08g��˵������Ag�����ʵ�����0.01mol��ת�Ƶ��ӵ����ʵ�����0.01mol������������������ʵ�����0.01mol/4=0.0025mol����״���µ������0.0025mol��22.4L/mol=0.056L=56mL;
(3)���ձ����Ȼ�ͭ��Һ������Ȼ�ͭ��Һ�������IJ����������������IJ�����Cu������0.01mol����ͨ��ʱ���CuCl2�����ʵ�����0.01mol/2=0.005mol,ԭ����Һ��CuCl2�����ʵ�����0.1L��0.15 mol��L-1=0.015mol������Һ�л�ʣ��CuCl2�����ʵ�����0.015-0.005=0.01mol�����Դ�ʱ��Һ�����ʵ���Ũ�Ƚ���Ϊ0.01mol/0.1L=0.1mol/L;
(4)ʹ��ɫʯ����Һ���ɫ���������ᣬA���������������ӷŵ磬������Ũ������������ǿ������A����������Һ���;�����������Һ���ܷ���ʽΪ4 AgNO3+2H2O![]() 4H NO3+O2��+4Ag���������յõ�����Һ��������Һ��
4H NO3+O2��+4Ag���������յõ�����Һ��������Һ��

����Ŀ�������й�ʵ��IJ�����ȷ����
ʵ�� | ���� | |
A�� | ����ϡ���� | �Ƚ�Ũ��������ձ��У���������ˮ |
B�� | ��ˮ�ռ�KMnO4�ֽ������O2 | ��Ϩ��ƾ��ƣ����Ƴ����� |
C�� | Ũ������MnO2��Ӧ�Ʊ�����Cl2 | ���������ͨ��Ũ���ᣬ��ͨ������ʳ��ˮ |
D�� | CCl4��ȡ��ˮ�е�I2 | �ȴӷ�Һ©���¿ڷų��л��㣬����Ͽڵ���ˮ�� |