题目内容
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.其中炉渣的主要成分是Fe0、Fe203、Si02、Al203.各物质有如下转化关系,

请回答:
(1)写出能证明SO2具有氧化性且现象明显的化学方程式______.
(2)用NaOH溶液吸收SO2,所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是______.
(3)写出Cu2S熔炼制取粗铜的化学方程式______
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+):C(Pb2+)=______.已知:Ksp(PbS)=3.4×10-28mol?L-2,Ksp(Zns)=1.6×10-24mol?L-2.
(5)写出证明溶液I中含有Fe2+的实验过程______o
(6)Na2FeO4能杀菌净水的原因是______
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-.请写出放电时正极电极反应式______.

请回答:
(1)写出能证明SO2具有氧化性且现象明显的化学方程式______.
(2)用NaOH溶液吸收SO2,所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量浓度由大到小的顺序是______.
(3)写出Cu2S熔炼制取粗铜的化学方程式______
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+):C(Pb2+)=______.已知:Ksp(PbS)=3.4×10-28mol?L-2,Ksp(Zns)=1.6×10-24mol?L-2.
(5)写出证明溶液I中含有Fe2+的实验过程______o
(6)Na2FeO4能杀菌净水的原因是______
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-.请写出放电时正极电极反应式______.
(1)二氧化硫与硫化氢的水溶液发生反应生成单质硫沉淀:SO2+2H2S=3S↓+2H2O,SO2体现了氧化性且现象明显,故答案为:SO2+2H2S=3S↓+2H2O;
(3)NaHSO3溶液中亚硫酸氢根离子无论电离还是水解都是较微弱的,NaHSO3溶液呈酸性,说明亚硫酸氢根离子水解程度小于电离程度,所以c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(2)工业上可用Cu2S和O2反应制取粗铜,元素化合价铜元素化合价降低,硫XYZ元素化合价升高,氧气中氧元素化合价降低,说明亚铜被还原,硫元素被氧化,发生的氧化还原反应为Cu2S+O2
2Cu+SO2,故答案为:Cu2S+O2
2Cu+SO2;
(4)C(Zn2+):C(Pb2+)=
=
=4.7×10-3;
(5)酸性KMnO4溶液能氧化Fe2+,溶液颜色褪去,故答案为:取少量溶液于试管中,然后滴加少量酸性KMnO4溶液,紫色褪去,证明有Fe2+;
(6)Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;故答案为:Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;
(7)反应原理为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-,正极电极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OHˉ,故答案为:FeO42-+3e-+4H2O═Fe(OH)3+5OH-.
(3)NaHSO3溶液中亚硫酸氢根离子无论电离还是水解都是较微弱的,NaHSO3溶液呈酸性,说明亚硫酸氢根离子水解程度小于电离程度,所以c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(2)工业上可用Cu2S和O2反应制取粗铜,元素化合价铜元素化合价降低,硫XYZ元素化合价升高,氧气中氧元素化合价降低,说明亚铜被还原,硫元素被氧化,发生的氧化还原反应为Cu2S+O2
| ||
| ||
(4)C(Zn2+):C(Pb2+)=
| Ksp(Zns) |
| Ksp(Pbs) |
| 1.6×10-24 |
| 3.4×10-28 |
(5)酸性KMnO4溶液能氧化Fe2+,溶液颜色褪去,故答案为:取少量溶液于试管中,然后滴加少量酸性KMnO4溶液,紫色褪去,证明有Fe2+;
(6)Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;故答案为:Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;
(7)反应原理为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-,正极电极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OHˉ,故答案为:FeO42-+3e-+4H2O═Fe(OH)3+5OH-.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
 ①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红试液褪色,加热后又显红色 ④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红试液褪色,加热后又显红色 ④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
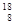 O,则它与乙酸反应生成的酯的相对分子质量为( )。
O,则它与乙酸反应生成的酯的相对分子质量为( )。