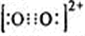题目内容
确定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A的第一电离能______B的第一电离能(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示,其中TiN中N呈-3价),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ?mol-1 | 715 | 3791 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______.
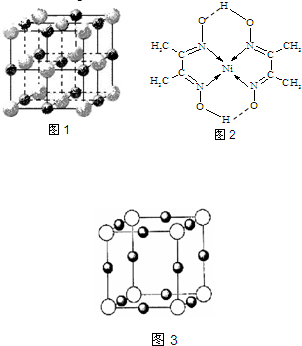
(4)某配合物的分子结构如图2所示,其分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢 键 F.非极性键
(5)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示.X的元素符号是______,与同一个N3-相连的X+有______个.
(6)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是______
A.SP,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
(7)CaC2中
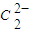 与
与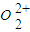 互为等电子体,
互为等电子体,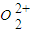 的电子式可表示为______;1mol
的电子式可表示为______;1mol  中含有的π键数目为______.
中含有的π键数目为______.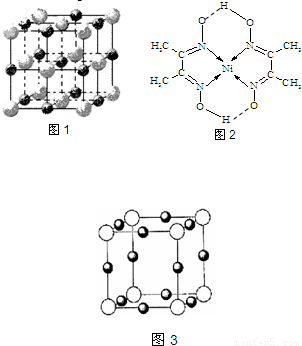
【答案】分析:(1)根据第一至第四电离能的变化可判断出各元素的最高化合价,进而推断元素的种类,周期表中,同周期元素从左到右电负性逐渐增强,元素的电子处于全满、半满或全空最稳定;
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,据此判断四种物质熔点高低,采用X、Y、Z三轴切割的方法确定镁离子个数;
(3)根据离子核外电子排布式确定未成对电子个数,金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好;
(4)同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,含有孤电子对和含有空轨道的原子间易形成配位键,N、O、F与与另一分子的H原子易形成氢键;
(5)K、L、M三个电子层全充满的X+中原子序数=核内质子数=电子数+电荷数,据此确定该元素,采用X、Y、Z三轴切割的方法确定X+个数;
(6)根据B原子含有的价层电子对个数确定杂化方式,N、O、F与与另一分子的H原子易形成氢键,注意氢键比范德华力大;
(7)CaC2中 与
与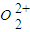 、N2都互为等电子体,根据氮气分子的电子式写出
、N2都互为等电子体,根据氮气分子的电子式写出 的电子式,根据每个
的电子式,根据每个 中的π键个数计算1mol
中的π键个数计算1mol  中含有的π键数目.
中含有的π键数目.
解答:解:(1)从表中原子的第一至第四电离能可以看出,A的第三电离能小,第四电离能较大,说明易失去3个电子,
则A的化合价为+3价,应为Al元素,B的第二电离较小,第三电离能较大,说明易失去2个电子,则B的化合价为+2价,应为Mg元素,镁的电负性小于铝的,而铝的第一电离能小于镁的;
故答案为:+3;>;<;
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,氮离子电荷大于镁离子和钙离子,镁、钙离子电荷大于钾离子,镁离子半径小于钙离子半径,所以4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl,采用X、Y、Z三轴切割的方法知,镁离子周围和它最邻近且等距离的Mg2+有12个,
故答案为:TiN>MgO>CaO>KCl;12;
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,V 5+核外电子排布式为1S22S22P63S23P6,核外没有孤电子,Cr4+核外电子排布式为1S22S22P63S23P63d1,有1个孤电子,所以适合作录音带磁粉原料的是CrO2,故答案为:CrO2;
(4)该配合物中,碳原子和碳原子之间存在非极性共价键,碳原子和氢原子之间存在极性共价键,镍原子和氮原子之间存在配位键,氧原子和另一分子的氢原子间存在氢键,
故选AC;
(5)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则该原子含有29个电子为铜元素,采用X、Y、Z三轴切割的方法知X+个数是6;
故答案为:Cu;6;
(6)在硼酸[B(OH)3]分子中,每个B原子含有3个σ键,不含孤电子对,所以采取sp2杂化,N、O、F与与另一分子的H原子易形成氢键,氢键比范德华力大,所以同层分子间的主要作用力是氢键,故选C;
(7)CaC2中 与
与 、N2都互为等电子体,由氮气分子的电子式知
、N2都互为等电子体,由氮气分子的电子式知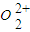 的电子式为
的电子式为 ,每个
,每个 中含有2个π键,所以1mol
中含有2个π键,所以1mol  中含有的π键数目是2NA,
中含有的π键数目是2NA,
故答案为: ;2NA.
;2NA.
点评:本题考查晶体的结构和性质,题目难度较大,本题注意把握电子排布式的书写、晶体类型的判断以及晶体结构的分析等方法性问题的总结和积累.
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,据此判断四种物质熔点高低,采用X、Y、Z三轴切割的方法确定镁离子个数;
(3)根据离子核外电子排布式确定未成对电子个数,金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好;
(4)同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键,含有孤电子对和含有空轨道的原子间易形成配位键,N、O、F与与另一分子的H原子易形成氢键;
(5)K、L、M三个电子层全充满的X+中原子序数=核内质子数=电子数+电荷数,据此确定该元素,采用X、Y、Z三轴切割的方法确定X+个数;
(6)根据B原子含有的价层电子对个数确定杂化方式,N、O、F与与另一分子的H原子易形成氢键,注意氢键比范德华力大;
(7)CaC2中
 与
与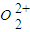 、N2都互为等电子体,根据氮气分子的电子式写出
、N2都互为等电子体,根据氮气分子的电子式写出 的电子式,根据每个
的电子式,根据每个 中的π键个数计算1mol
中的π键个数计算1mol  中含有的π键数目.
中含有的π键数目.解答:解:(1)从表中原子的第一至第四电离能可以看出,A的第三电离能小,第四电离能较大,说明易失去3个电子,
则A的化合价为+3价,应为Al元素,B的第二电离较小,第三电离能较大,说明易失去2个电子,则B的化合价为+2价,应为Mg元素,镁的电负性小于铝的,而铝的第一电离能小于镁的;
故答案为:+3;>;<;
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,氮离子电荷大于镁离子和钙离子,镁、钙离子电荷大于钾离子,镁离子半径小于钙离子半径,所以4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl,采用X、Y、Z三轴切割的方法知,镁离子周围和它最邻近且等距离的Mg2+有12个,
故答案为:TiN>MgO>CaO>KCl;12;
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好,V 5+核外电子排布式为1S22S22P63S23P6,核外没有孤电子,Cr4+核外电子排布式为1S22S22P63S23P63d1,有1个孤电子,所以适合作录音带磁粉原料的是CrO2,故答案为:CrO2;
(4)该配合物中,碳原子和碳原子之间存在非极性共价键,碳原子和氢原子之间存在极性共价键,镍原子和氮原子之间存在配位键,氧原子和另一分子的氢原子间存在氢键,
故选AC;
(5)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则该原子含有29个电子为铜元素,采用X、Y、Z三轴切割的方法知X+个数是6;
故答案为:Cu;6;
(6)在硼酸[B(OH)3]分子中,每个B原子含有3个σ键,不含孤电子对,所以采取sp2杂化,N、O、F与与另一分子的H原子易形成氢键,氢键比范德华力大,所以同层分子间的主要作用力是氢键,故选C;
(7)CaC2中
 与
与 、N2都互为等电子体,由氮气分子的电子式知
、N2都互为等电子体,由氮气分子的电子式知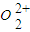 的电子式为
的电子式为 ,每个
,每个 中含有2个π键,所以1mol
中含有2个π键,所以1mol  中含有的π键数目是2NA,
中含有的π键数目是2NA,故答案为:
 ;2NA.
;2NA.点评:本题考查晶体的结构和性质,题目难度较大,本题注意把握电子排布式的书写、晶体类型的判断以及晶体结构的分析等方法性问题的总结和积累.

练习册系列答案
相关题目
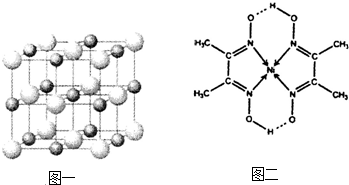 (3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表:
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图一所示),其中3种离子晶体的晶格能数据如下表: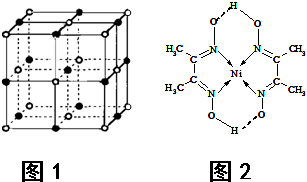 (2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.
(2013?渭南二模)决定物质性质的重要因素是物质结构.请回答下列问题.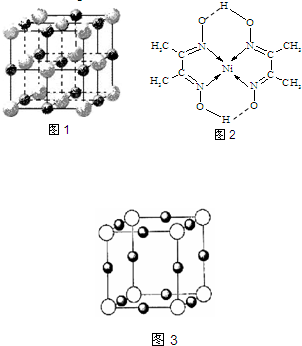 确定物质性质的重要因素是物质结构.请回答下列问题.
确定物质性质的重要因素是物质结构.请回答下列问题.