题目内容
取一定质量的Fe、Cu混合物的粉末平均分成四等份,分别加入不同体积但同浓度的稀硝酸,实验中收集到的NO气体的体积及剩余固体的质量均记录在下表中(气体体积均在标准状况下测定)。实验序号 | ① | ② | ③ | ④ |
稀硝酸体积 | 100 Ml | 200 mL |
| 400 mL |
剩余固体质量 | 17.2 g | 8.00 g | 固体恰好全部溶解 | 0 |
气体体积 | 2.24 L | 4.48 L |
|
|
求:(1)计算稀硝酸的物质的量浓度。
(2)填写上表中的空格。
(1)c(HNO3)=4.00 mol·L-1
(2)
③ | ④ |
283 mL |
|
|
|
6.35 L | 7.84 L |
解析:本题以氧化还原反应为载体,考查守恒法技巧的运用和计算能力。
(1)由实验①中有金属剩余可知,反应①中金属必显+2价。则据方程式:
3M+8HNO3(稀)====3M(NO3)2+2NO↑+4H2O ①
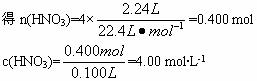
(2)由实验②与实验①的数据分析,平均每失1 mol电子溶解的金属的质量为:
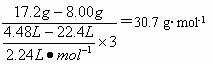
该值小于Cu的32 g·mol-1,大于Fe的28 g·mol-1,所以,溶解的金属是铁与铜的混合物。8.00 g金属是铜。
当溶解8.00 g铜时(固体恰好全部溶解),据方程式①得:
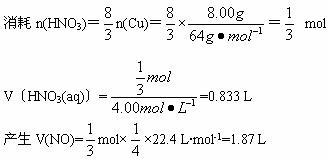
所以,实验③共用稀硝酸:200 mL+83.3 mL=283 mL。共产生气体:4.48 L+1.87 L=6.35 L。
据题意,实验②比实验①多溶解的金属中有如下关系:
![]()
解得:在溶解的9.2 g金属中有铁0.050 mol,铜0.10 mol。
当加入400 mL稀硝酸时,金属完全被氧化,在实验③的基础上,金属元素再失电子:
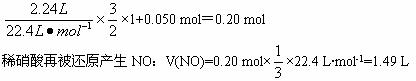
所以,实验④共产生气体6.35 L+1.49 L=7.84 L。

练习册系列答案
相关题目
Fe2O3具有广泛的用途.
甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3.为了进一步验证此结论,他做了如下实验:
由此甲同学得出结论:4FeCO3+O2
2Fe2O3+4CO2
(1)写出实验步骤Ⅲ中发生反应的离子方程式 .
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+.他需要选择的试剂是 (填序号).
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分.你认为丙同学持此看法的理由是 .
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中,的确含有+2价铁元素.于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、 (填名称)和 (填名称);再 (填操作名称),灼烧,即可得到Fe2O3.
甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3.为了进一步验证此结论,他做了如下实验:
| 实验步骤 | 实验操作 |
| I | 取一定质量的FeCO3固体置于坩埚中,高温燃烧至质量不再减轻,冷却至室温. |
| II | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解. |
| III | 向实验步骤II所得溶液中滴加KSCN溶液,溶液变红. |
| ||
(1)写出实验步骤Ⅲ中发生反应的离子方程式
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+.他需要选择的试剂是
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分.你认为丙同学持此看法的理由是
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中,的确含有+2价铁元素.于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、
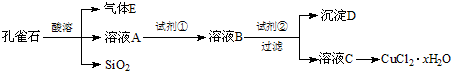
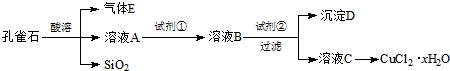
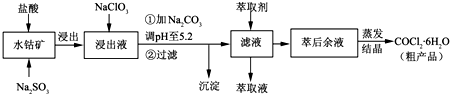
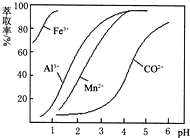
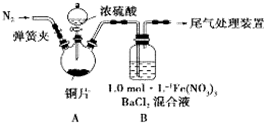 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.