题目内容
【题目】在2L的密闭容器中,起始时均投入2mol CO,在不同条件下发生反应:CO(g) +2H2(g) ![]() CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
CH3OH(g) △H <0。有关信息如图所示,下列说法正确的是
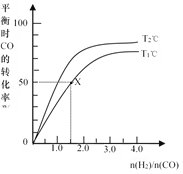
A. T1<T2
B. T1℃时该反应的平衡常数为4.0 L2·mol-2
C. 同一温度下,n(H2)/n(CO)越大,平衡常数也越大
D. 同条件下n(H2)/n(CO)越大,CO和H2的转化率也越大
【答案】B
【解析】A、此反应是放热反应,降低温度,平衡向正反应方向移动,CO的转化率增大,即T1>T2,故A错误;
B、CO(g) +2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始: 2 3 0
变化: 1 2 1
平衡: 1 1 1 根据化学平衡常数的定义,K= ,代入数值,得出K=4,故B正确;C、化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,同一温度下,n(H2)/n(CO)增大,平衡常数不变,故C错误;D、同条件下,n(H2)/n(CO)越大,可以认为n(H2)增大,n(CO)不变,即氢气的转化率降低,CO的转化率增大,故D错误。
,代入数值,得出K=4,故B正确;C、化学平衡常数只受温度的影响,温度不变,则化学平衡常数不变,同一温度下,n(H2)/n(CO)增大,平衡常数不变,故C错误;D、同条件下,n(H2)/n(CO)越大,可以认为n(H2)增大,n(CO)不变,即氢气的转化率降低,CO的转化率增大,故D错误。

练习册系列答案
相关题目
