��Ŀ����
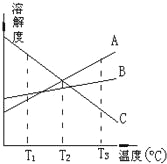
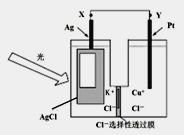
����Ŀ���мס��ҡ��������������ֶ�����Ԫ�أ�ԭ���������������䳣�����ϼ�����Ϊ+1��-2��+1��+3��-1�������γɵ����ʼ��ת����ϵ����ͼ��ʾ���������ö��Ե缫��⣨�������ӽ���Ĥ��1L l mol/L��A��Һ��
�밴Ҫ��ش��������⣺
��1����Ԫ�����Ԫ��ͬ���壬�ȱ�ԭ�Ӷ�2�����Ӳ㣬��ԭ������Ϊ_____________���Ʋ���ͬ�����±��������ʷֱ���ˮ��Ӧ���ҳ̶ȵ�������____________________��
��2���ס��ҡ��찴ԭ�������1��1��1�γɵĻ�����Y����Ư���ԣ������ʽΪ___________��
��3����ͼת����ϵ�в�����������ԭ��Ӧ���У����ţ�____________��
��4����ͨ��ͼ��·Ƭ�̺����ձ��еμ�һ���Լ����ɼ������缫����ʴ���˷�Ӧ�����ӷ���ʽΪ______��

��5������Ӧ�����һ��ʱ�����D��ҺpH=12�������£�����������ȫ�ݳ���ȡ������Ĥ����Һ��ֻ��ȣ�������Һ����仯������ʱ��ת�Ƶ�����ĿԼΪ________����Ӧ�������ӷ���ʽΪ_______________��
��6������ͼ�и�����Ӧ��Ϊǡ����ȫת����������X�к��е����ʣ���ˮ�⣩��_________________��
���𰸡���1��37������ͬ����Ԫ�صĽ�������˵���������Ӷ���ǿ���Ʋ⼺������ˮ��Ӧ�ϱ������ң�1�֣��������֣�
��2��![]() ����3������
����3������
��4��3Fe2++2[Fe��CN��6]3- =Fe3[Fe��CN��6]2����
��5��6.02��l021�� 2A1+2OH-+2H2O=2AlO2-+3H2�� ��
��6��NaCl��Al��OH��3
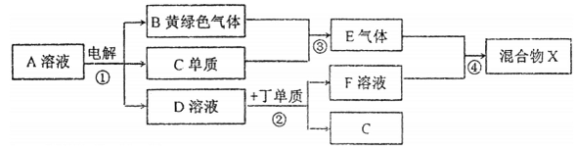
��������������������������֪��A��NaCl��B��Cl2��C��H2��D��NaOH��E��HCl������Al��F��NaAlO2��X��NaCl��AlCl3�Ļ�������Ԫ�صĻ��ϼۼ�Ԫ�ص�ԭ�������Ĺ�ϵ��֪����H������O������Na������Al������Cl������Rb��ԭ��������37���ơ�� ͬһ�����Ԫ�أ����ڴ��ϵ���ԭ�Ӱ뾶������ԭ��ʧȥ���ӵ���������ǿ������������ˮ��Ӧ����������ǿ����ӦԽ��Խ���ң���2���ס��ҡ��찴ԭ�������1��1��1�γɵĻ�����Y��HClO�������ʾ���ǿ�������ԣ��ʾ���Ư���ԣ������ʽΪ![]() ����3������ͼת����ϵ���٢ڢ���Ӧ����Ԫ�ػ��ϼ۵ı仯����������������ԭ��Ӧ��������Ԫ�صĻ��ϼ�û�з����仯�����Ը÷�Ӧ�Ƿ�������ԭ��Ӧ����4���繹��ԭ��أ�Fe����ʴ����FeΪ������������Ӧ��Fe-2e-=Fe2+��Fe2+��[Fe��CN��6]3-�ᷢ����Ӧ������ɫ��������Ӧ�����ӷ���ʽ�ǣ�3Fe2++2[Fe��CN��6]3- =Fe3[Fe��CN��6]2������5��NaCl��Һ���Ļ�ѧ����ʽ�ǣ�2NaCl��2H2O
����3������ͼת����ϵ���٢ڢ���Ӧ����Ԫ�ػ��ϼ۵ı仯����������������ԭ��Ӧ��������Ԫ�صĻ��ϼ�û�з����仯�����Ը÷�Ӧ�Ƿ�������ԭ��Ӧ����4���繹��ԭ��أ�Fe����ʴ����FeΪ������������Ӧ��Fe-2e-=Fe2+��Fe2+��[Fe��CN��6]3-�ᷢ����Ӧ������ɫ��������Ӧ�����ӷ���ʽ�ǣ�3Fe2++2[Fe��CN��6]3- =Fe3[Fe��CN��6]2������5��NaCl��Һ���Ļ�ѧ����ʽ�ǣ�2NaCl��2H2O![]() Cl2����H2����2NaOH���ڸ÷�Ӧ�У�ÿת��2mol���ӣ���Ӧ�����2molNaOH��n��NaCl��=1L��1mol/L=1mol����NaCl�����ȫ��Ӧת��1mol���ӣ���Ӧ����1molNaOH������Ӧ�����һ��ʱ�����D��ҺpH=12��n��NaOH��=10-2mol/L��1L=0.01mol��1mol��˵��NaClû����ȫ��⣬�����ת�Ƶ����ʵ�����0.01mol������ת�Ƶ���ĿԼ��N��e-��=0.01mol��6.02��1023/mol= 6.02��l021����Ӧ����Al��NaOH��Һ��Ӧ����Ӧ�����ӷ���ʽΪ2A1+2OH-+2H2O=2AlO2-+3H2������6������ͼ�и�����Ӧ��Ϊǡ����ȫת������4HCl+NaAlO2=NaCl+AlCl3�����Ի����X�к��е�������NaCl��Al��OH��3��
Cl2����H2����2NaOH���ڸ÷�Ӧ�У�ÿת��2mol���ӣ���Ӧ�����2molNaOH��n��NaCl��=1L��1mol/L=1mol����NaCl�����ȫ��Ӧת��1mol���ӣ���Ӧ����1molNaOH������Ӧ�����һ��ʱ�����D��ҺpH=12��n��NaOH��=10-2mol/L��1L=0.01mol��1mol��˵��NaClû����ȫ��⣬�����ת�Ƶ����ʵ�����0.01mol������ת�Ƶ���ĿԼ��N��e-��=0.01mol��6.02��1023/mol= 6.02��l021����Ӧ����Al��NaOH��Һ��Ӧ����Ӧ�����ӷ���ʽΪ2A1+2OH-+2H2O=2AlO2-+3H2������6������ͼ�и�����Ӧ��Ϊǡ����ȫת������4HCl+NaAlO2=NaCl+AlCl3�����Ի����X�к��е�������NaCl��Al��OH��3��

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д�����Ŀ��Ҫ����450mL 0.2molL��1FeSO4��Һ��ʵ����������У�
������ƽ�ϳ�ȡa g�̷���FeSO47H2O�������������ձ��У�����������ˮʹ����ȫ�ܽ⣻
����������Һ�ز�����ע������ƿ�У�
������������ƿ�м�ˮ��Һ���̶���1��2cm�������ý�ͷ�ιܵμ�����ˮ����Һ��ײ���̶������У�
��������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴҺ��ת������ƿ��
��������ƿ���������ҡ�ȣ�
��д���пհף�
��a g�̷���ʵ������Ϊ g��
�����������������ȷ˳��Ϊ ��
�����в�����ʹ������Һ��Ũ��ƫ�ߵ��� ��
A��������ʱ��©�������� |
B������ʱ���ӿ̶��ߣ� |
C������ʱ���ŷ��ˣ� |
D���̷���Ʒ�Ѳ��ַ绯�� |
E��ҡ�Ⱥ���Һ���ڿ̶��ߣ��ټ�������ˮʹҺ����͵���̶������У�
F������ʱ���������ڿ̶����Ϸ���
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | ��������ռ�������������3/8 |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | Ԫ�����������+7�� |
��1��Ԫ��X��һ��ͬλ�ؿɲⶨ�����������ͬλ��������Ϊ8������ͬλ�صķ����� ��
��2��Y���⻯����Y������������ˮ���ﷴӦ���ɵ���������Ϊ��
��3��Z������Ԫ�ص������⻯���У��е���͵����ʵĻ�ѧʽΪ��
��4��̽Ѱ���ʵ����ʲ�������ѧϰ����Ҫ����֮һ��T��X��Y��Z����Ԫ�ص�����������ˮ�����л�ѧ�������Բ�ͬ��������������� �������ʽ�������������� ��