题目内容
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O
CO+3H2
(2)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O△H>0.请在坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图如图1,并进行必要标注.
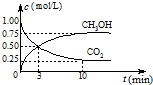
(3)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从3min到10min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使
增大的是
A.升高温度
B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入1mol CO2和3mol H2.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
C
C
.(填字母序号)A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| 高温 |
(2)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.

2CO2(g)+6H2(g)→CH3OCH3(g)+3H2O△H>0.请在坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图如图1,并进行必要标注.
(3)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从3min到10min,v(H2)=
0.11
0.11
mol/(L?min).②能说明上述反应达到平衡状态的是
D
D
(选填编号).A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使
| n(CH3OH) |
| n(CO2) |
CD
CD
(选填编号).A.升高温度
B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入1mol CO2和3mol H2.
分析:(1)有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢是最节能的,减少电能、天然气、热能的利用;
(2)催化剂可降低反应所需的活化能,加快反应速率,缩短反应到达平衡的时间;
(3)根据图象计算v(CO2),根据反应速率之比等于化学计量数之比计算;
②当达到化学平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断;
③能使n (CH3OH)/n (CO2)增大,应使平衡向正反应方向移动.
(2)催化剂可降低反应所需的活化能,加快反应速率,缩短反应到达平衡的时间;
(3)根据图象计算v(CO2),根据反应速率之比等于化学计量数之比计算;
②当达到化学平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断;
③能使n (CH3OH)/n (CO2)增大,应使平衡向正反应方向移动.
解答:解:(1)A、消耗电能,不是最节能的方法,故A错误;
B.消耗热能,不是减碳的手段,故B错误;
C.利用太阳光催化分解水制氢是最节能的,故C正确;
D.天然气是非再生能源,且不是最节能的方法,故D错误;
故选C;
(2)催化剂可降低反应所需的活化能,加快反应速率,缩短反应到达平衡的时间,但放出的能量不变,所以其图象为: ,
,
故答案为: ;
;
(3)①v(CO2)=
,则v(H2)=3v(CO2)=3×
=0.11mol/(L?min),故答案为:0.11;
②A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故答案为:D;
③A.升高温度,平衡向逆反应方向移动,则比值减小,故A错误;
B.恒温恒容充入He(g),平衡不移动,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方向移动,故C正确;
D.恒温恒容再充入1mol CO2和3mol H2,相当于在原来基础上缩小体积,压强增大,平衡向正反应方向移动,故D正确,
故答案为:CD.
B.消耗热能,不是减碳的手段,故B错误;
C.利用太阳光催化分解水制氢是最节能的,故C正确;
D.天然气是非再生能源,且不是最节能的方法,故D错误;
故选C;
(2)催化剂可降低反应所需的活化能,加快反应速率,缩短反应到达平衡的时间,但放出的能量不变,所以其图象为:
 ,
,故答案为:
 ;
;(3)①v(CO2)=
| 0.25mol/L |
| 7min |
| 0.25mol/L |
| 7min |
②A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确;
故答案为:D;
③A.升高温度,平衡向逆反应方向移动,则比值减小,故A错误;
B.恒温恒容充入He(g),平衡不移动,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方向移动,故C正确;
D.恒温恒容再充入1mol CO2和3mol H2,相当于在原来基础上缩小体积,压强增大,平衡向正反应方向移动,故D正确,
故答案为:CD.
点评:本题综合考查化学平衡知识,题目难度较大,注意反应速率的计算、平衡状态的判断,注意催化剂只能改变反应速率,不能改变反应中放出或吸收的能量,为易错点.

练习册系列答案
相关题目
 CO+3H2
CO+3H2 CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,并达平衡.