题目内容
【题目】化学——选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
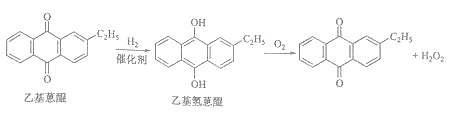
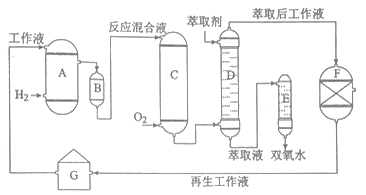
A氢化釜 B过滤器 C氧化塔 D萃取塔
E净化塔 F工作液再生装置 G工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
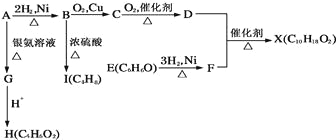
(1)蒽醌法制备双氧水理论上消耗的原料是___________,循环使用的原料是__________,配制工作液时采用有机溶剂而不采用水的原因是__________。
(2)氢化釜A中反应的化学方程式为___________,进入氧化塔C的反应混合液中的主要溶质为___________
(3)萃取塔D中的萃取剂是________,选择其作萃取剂的原因是______________。
(4)工作液再生装置F中要除净残留的H2O2,原因是______________。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为___ _____一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为__ ____mol/L。
【答案】(1)氢气和氧气 乙基蒽醌 乙基蒽醌(乙基氢蒽醌)不溶于水,易溶于有机溶剂;
(2)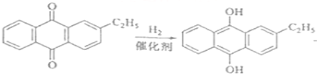
乙基氢蒽醌;
(3)水 H2O2溶于水被水萃取,乙基蒽醌不溶于水;
(4)H2O2分解放出氧气,与氢气混合,易发生爆炸;
(5)6H++5H2O2+2MnO4-=2Mn2++8H2O +5O2↑ 8.9
【解析】
试题分析:根据采用蒽醌法制备双氧水的原理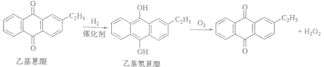 可知需要消耗的原料是氢气和氧气,乙基蒽醌可以循环使用,乙基蒽醌属于疏水性有机化合物,不溶于水,易溶于有机溶剂,答案为:氢气和氧气 乙基蒽醌 乙基蒽醌(乙基氢蒽醌)不溶于水,易溶于有机溶剂;(2)氢化釜A中发生的反应是乙基蒽醌和氢气在催化剂存在的条件下发生的加氢反应生成乙基氢蒽醌,化学方程式为:
可知需要消耗的原料是氢气和氧气,乙基蒽醌可以循环使用,乙基蒽醌属于疏水性有机化合物,不溶于水,易溶于有机溶剂,答案为:氢气和氧气 乙基蒽醌 乙基蒽醌(乙基氢蒽醌)不溶于水,易溶于有机溶剂;(2)氢化釜A中发生的反应是乙基蒽醌和氢气在催化剂存在的条件下发生的加氢反应生成乙基氢蒽醌,化学方程式为: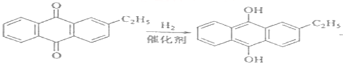 ,进入氧化塔C中的主要溶质是乙基氢蒽醌,答案为:
,进入氧化塔C中的主要溶质是乙基氢蒽醌,答案为: ,乙基氢蒽醌;(3)根据反应原理可知氧化塔C中得到的主要物质是乙基蒽醌和过氧化氢,过氧化氢溶于水,乙基蒽醌不溶于水,所以可以用水来萃取,所以萃取剂是水,答案为:水 H2O2溶于水被水萃取,乙基蒽醌不溶于水;(4)工作液再生装置F中要除净残留的H2O2,原因是过氧化氢易分解生成水和氧气,氢气和氧气混合易发生爆炸,答案为:H2O2分解放出氧气,与氢气混合,易发生爆炸;(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,原理是高锰酸钾氧化过氧化氢,反应的离子方程式为6H++5H2O2+2MnO4-=2Mn2++8H2O +5O2↑,一种双氧水的质量分数为27.5%,(密度为1.10g·cm3)根据
,乙基氢蒽醌;(3)根据反应原理可知氧化塔C中得到的主要物质是乙基蒽醌和过氧化氢,过氧化氢溶于水,乙基蒽醌不溶于水,所以可以用水来萃取,所以萃取剂是水,答案为:水 H2O2溶于水被水萃取,乙基蒽醌不溶于水;(4)工作液再生装置F中要除净残留的H2O2,原因是过氧化氢易分解生成水和氧气,氢气和氧气混合易发生爆炸,答案为:H2O2分解放出氧气,与氢气混合,易发生爆炸;(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,原理是高锰酸钾氧化过氧化氢,反应的离子方程式为6H++5H2O2+2MnO4-=2Mn2++8H2O +5O2↑,一种双氧水的质量分数为27.5%,(密度为1.10g·cm3)根据![]() ,答案为:8.9.
,答案为:8.9.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】(本题12分)如图是元素周期表的框架,请在表中①~⑩元素中回答问题

请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为______。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为______。
(3)⑧与⑩两种元素非金属较强的是______,请用一个离子方程式证明该结论______。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式______,电池工作时阴离子定向移动到______极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为______kJ。
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |