题目内容
【题目】在建国70周年阅兵仪式上,“歼20”“东风-41 核导弹”等国之重器亮相,它们采用了大量合金材料。回答下列问题:
(1)查阅资料显示第二电离能 Cu 大于 Zn,理由是 _____________。
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为______,S的_____杂化轨道与O的2p轨道形成______键(填“π”或“σ”)。
(3)铁元素能与 CO 形成 Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为____。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为__(填字母序号)。
A.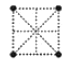 B.
B.  C.
C.  D .
D .
a. 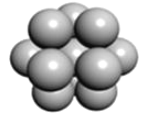 b.
b.  c.
c. 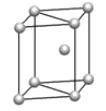
(5) 镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__;晶胞是图中的_(填 a、b 或 c);配位数是___;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,则镁的摩尔质量的计算式是_______。
【答案】锌失去 4s1电子,而铜失去 3d10 电子,后者全充满较稳定,更难失去 正四面体 sp3 σ 10 CN- D 六方最密堆积 c 12 12NAaρ
【解析】
(1)第二电离能 Cu 大于 Zn,理由是锌失去 4s1电子,而铜失去 3d10 电子,后者全充满较稳定,更难失去。故答案为:锌失去 4s1电子,而铜失去 3d10 电子,后者全充满较稳定,更难失去;
(2)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中硫酸根离子中心原子价层电子对为:4+![]() =4,S采用sp3,没有孤电子对,立体构型为正四面体,S的sp3杂化轨道与O的2p轨道形成σ键。故答案为:正四面体;sp3;σ;
=4,S采用sp3,没有孤电子对,立体构型为正四面体,S的sp3杂化轨道与O的2p轨道形成σ键。故答案为:正四面体;sp3;σ;
(3)1molFe(CO)5分子中含C-O键和铁碳配位键各5mol,共10molσ键,将CO中O换成N得与CO互为等电子体的一种离子的化学式为CN-。故答案为:10;CN-;
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为![]() 。故答案为:D;
。故答案为:D;
(5)镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,镁单质晶体中原子的堆积模型名称为六方最密堆积;晶胞是图中的 c;配位数是12;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ gcm-3,已知阿伏德罗常数为NA,由于紧邻的四个镁原子的中心连线构成的几何体为正四面体,正四面体的该高为晶胞的![]() ,可推知四面体的体积为整个晶胞的
,可推知四面体的体积为整个晶胞的![]() ,而晶胞中含有的镁原子数为1+8×
,而晶胞中含有的镁原子数为1+8×![]() =2,则晶胞质量=
=2,则晶胞质量=![]() g,则ρg·cm-3=
g,则ρg·cm-3=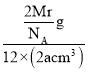 ,则有Mr=12NA·a·ρ,则镁的摩尔质量的计算式是12NAaρ。故答案为:六方最密堆积;c;12;12NAaρ。
,则有Mr=12NA·a·ρ,则镁的摩尔质量的计算式是12NAaρ。故答案为:六方最密堆积;c;12;12NAaρ。

【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行