题目内容
【题目】为了验证SO2的性质,某同学利用输液管设计了如下微型实验:
回答下列问题:
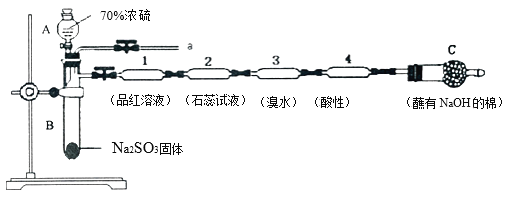
(1)仪器A的名称是__________。
(2)装置l中的现象是______;装置3中证明SO2具有______性。
(3)下列说法正确的是____________。
A.装置2中紫色石蕊试液变红的原因是SO2+H2O=H2SO3, H2SO3显酸性
B.实验结束后将输液管1加热溶液不变色
C.实验结束后,可由a导管向装置中加水,将气体赶出后再拆装置,防止残留的SO2有毒气体污染环境
D.在a导管处用向下排空气法收集SO2
(4)装置4中酸性高锰酸钾褪色,经测定反应后溶液中含有Mn2+和SO42—,请写出该反应的离子方程式__________。
(5)该学生还利用上图部分仪器组装成的装置(如图)证明S、C、Si非金属性强弱。可共选择的试剂有:硫酸、亚硫酸、硝酸、木炭、硅酸钠溶液。
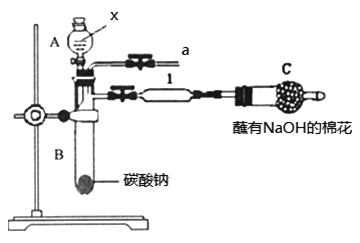
①装置A中试剂X是_______;装置1中反应的化学方程式是________。
②实验结论:因为酸性强弱是____>_____>_____(填化学式),故非金属性是S>C>Si。
【答案】 分液漏斗 褪色 还原 AC 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ 硫酸 CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3 H2SO4 H2CO3 H2SiO3
【解析】本题考查实验方案设计的评价,(1)仪器A为分液漏斗;(2)装置B中发生反应的是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,SO2能使品红溶液褪色,即装置1中现象是品红溶液褪色;(3)A、SO2是酸性氧化物,与水反应生成H2SO3,石蕊遇酸变红,说明H2SO3显酸性,故A正确;B、SO2与品红生成不稳定的物质,受热又恢复到原来的颜色,故B错误;C、SO2易溶于水,且有毒,实验结束后必须尾气处理,故C正确;D、SO2的密度比空气大,应用向上排空气法收集,故D错误;(4)参加反应物质是SO2和KMnO4,生成的物质是Mn2+和SO42-,SO2中S的化合价由+4价→+6价,化合价升高2价,MnO4-中Mn化合价由+7价→+2价,化合价降低5价,最小公倍数为10,然后根据原子守恒,配平其他,即离子反应方程是5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;(5)①验证三种元素的非金属性强弱,需要对比三种元素最高价氧化物对应水化物的酸性,因此X为H2SO4,试管B中发生Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,装置1中发生SiO32-+CO2+H2O=H2SiO3↓+CO32-;②利用酸性强的制取酸性弱,即酸性强弱是H2SO4>H2CO3>H2SiO3。

 名校课堂系列答案
名校课堂系列答案