题目内容
【题目】(1)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是:N2(g)+3H2(g)=2NH3(l);⊿H= .
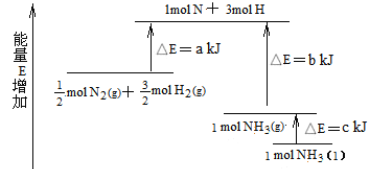
(2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2固体和H2O(l)。已知室温下2 g SiH4自燃放出热量89.2 kJ,该反应的热化学方程式为 。
(4)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(5)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=+64.39 kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196.46 kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.84 kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_________________。
(6).已知:反应H2(g)+Cl2(g)=2HCl(g) ΔH=—184kJ/mol
4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=—115.6kJ/mol
2Cl2(g)+2H2O(g) ΔH=—115.6kJ/mol
![]()
请回答:
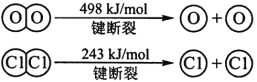
H2与O2反应生成气态水的热化学方程式
断开1 mol H—O 键所需能量约为 kJ
【答案】(1)-2(b+c-a)kJ·mol-1(或2(a—b—c)kJ·mol-1);
(2)2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=3116.6kJ·mol-1;
(3)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)ΔH=-1427.2kJ·mol-1;
(4)2△H1+3△H2—2△H3;
(5)Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68kJ.mol-1;
(6)2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ/mol,463.4。
【解析】
试题分析:(1)根据能量变化,△H=-2(b+c-a)kJ·mol-1;(2)根据信息,C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) △H=-1558kJ·mol-1;(3)32gSiH4反应产生的热量为32×89.2/2kJ=1427.2kJ,SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1;(4)①N2(g) + O2 (g) = 2NO(g) ,②2H2(g) + O2(g) = 2H2O(g),③N2(g) + 3H2(g) = 2NH3(g) ,2×①+3×②-2×③,得出:2△H1+3△H2—2△H3 ;(5)Cu+H2O2+2H+=Cu2++2H2O,因此有:①+②/2+③,得出:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=(64.39-196.46/2-285.84)kJ·mol-1=-319.68kJ·mol-1;(6)①H2(g) + Cl2(g) = 2HCl(g) ,②4HCl(g)+O2(g)=2Cl2(g)+2H2O(g),2×①+②得出2H2(g)+O2(g)=2H2O(g) △H=(-184×2-115.6)kJ·mol-1=-483.6kJ·mol-1,根据反应热和键能之间的关系,设氢氧键的键能为xkJ·mol-1,△H=2×436+498-4×x=-483.6,解得x=463.4。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
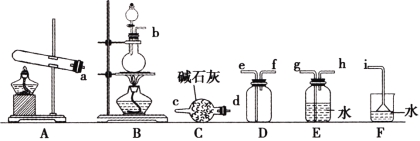
①氨气的发生装置可以选择上图中的 ,反应的化学方程式为 。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2 (两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
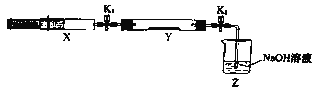
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开 | ③ | ④ |
