题目内容
为研究某铁质材料与浓硫酸反应生成气体的成分,某学习小组进行了以下探究活动:
(1)称取铁钉5.6g放入20mL足量浓硫酸中,加热,理论上收集到气体SO2 L(标况)。将所得气体全部通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体23.3g。由此推知实际生成气体SO2的体积为 L(标况)。
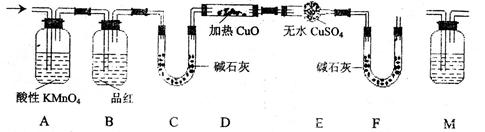
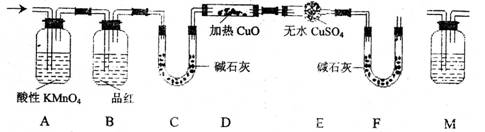
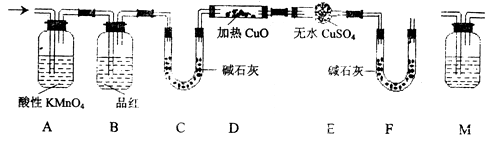
(2)分析上述实验中SO2体积的结果,有同学认为所得气体中除含有SO2外,还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
①装置A中试剂的作用是
②认为气体中还含有的Q气体是
③为确认Q的存在,需在装置中添加M于 ,
a.A之前 b.AB之间 c.BC之间 d.CD之间
M中的试剂是
④如果气体中含有H2,预计实验现象应是
(10分)(1)3.36(2分) 2.24(2分)
(2)①除去气体中的SO2(1分) ②CO2(1分) ③c (1分)澄清石灰水(1分)④D中固体由黑变红和E中固体由白变蓝(2分)
解析:略

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
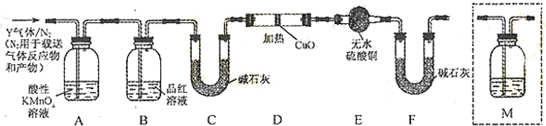
 SO2外,还可能含有H2和Q气体。为此设计了下
SO2外,还可能含有H2和Q气体。为此设计了下