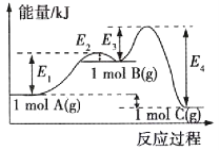
题目内容
【题目】海水是巨大的化学资源宝库,利用海水可以获取很多物质。海水中主要离子有Na+、K+、Ca2+、Mg2+、Cl-、SO42-等。
利用1:淡水工业
(1)海水淡化的方法主要有__、电渗析法、离子交换法等。
(2)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。
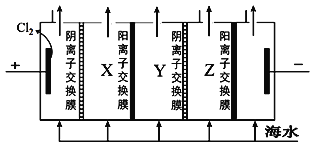
①淡水在__室(填X、Y或Z)形成后流出。
②一般海水不直接通入到阴极室中,原因是______________。
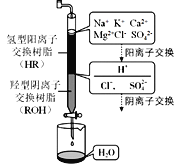
(3)离子交换法净化海水模拟过程如图所示,氢型阳离子交换原理可表示为:HR+Na+=NaR+H+,……。羟型阴离子交换树脂填充段存在的反应有______________。
利用2:提溴工业
(4)用海水晒盐之后的盐卤可提取溴,提取流程如图:

①用热空气将溴赶出,在吸收塔先用浓Na2CO3溶液吸收Br2,Br2歧化为Br-和BrO3-,再加入W溶液得到Br2。推测W是______________。
②蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是____________。
③将1m3海水浓缩至1L,使用该法最终得到38.4gBr2,若总提取率为60%,则原海水中溴的浓度是__mg/L。
【答案】蒸馏法 X、Z 海水中含有较多的Mg2+、Ca2+等阳离子,阴极电解产生OH-,容易生成Mg(OH)2和Ca(OH)2等沉淀附着在电极表面或堵塞阳离子交换膜 ROH+Cl=RCl+OH;2ROH+SO42=R2SO4+2OH;H++OH=H2O 硫酸 温度过低不利于溴的蒸出,温度过高会蒸出较多水蒸气 64
【解析】
(1)海水淡化方法有蒸馏法、电渗析法、离子交换法等;答案为:蒸馏法;
(2)①在电解池中,溶液中阴、阳离子分别通过阴、阳离子交换膜移向阳、阴极,从而在X、Z室形成淡水而流出;答案为:X、Z;
②海水中含Ca2+、Mg2+,在电解池的阴极中,阳离子放电后产生OH-,从而易形成沉淀附着在电极表面或堵塞离子交换膜。答案为:海水中含有较多的Mg2+、Ca2+等阳离子,阴极电解产生OH-,容易生成Mg(OH)2和Ca(OH)2等沉淀附着在电极表面或堵塞阳离子交换膜;
(3)分析氢型阳离子的交换原理可知,羟型阴离子发生的阴离子交换类似氢型阳离子的交换过程,根据图中海水净化模拟过程,其中涉及的反应方程式有:ROH+Cl=RCl+OH;2ROH+SO42=R2SO4+2OH;H++OH=H2O;答案为:ROH+Cl=RCl+OH;2ROH+SO42=R2SO4+2OH;H++OH=H2O;
(4)分析溴的提取流程,Cl2将盐卤中的Br-氧化为Br2,再通热空气将Br2吹出塔,在吸收塔先用浓Na2CO3溶液吸收Br2,Br2歧化为Br-和BrO3-,再加入H2SO4酸化歧化溶液得到Br2。
①在歧化溶液中加入H2SO4溶液,使其生成Br2,故答案为:硫酸;
②温度在90℃左右进行蒸馏,是因为温度过高有更多的水蒸气蒸出,温度过低,不利于溴的蒸出,答案为:温度过低不利于溴的蒸出,温度过高会蒸出较多水蒸气;
③根据题意,设原海水中溴的浓度是x mg/L,则有![]() ,x=64,答案为:64。
,x=64,答案为:64。