题目内容
在恒温恒容条件下,向容积为2L的密闭容器中充人2. O mol SO2和2. O mol O2。巳知: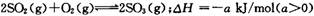 ,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
A 在1 min时: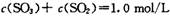
B. 2 min内: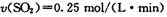
C. 若再充入2mol SO3,达平衡时SO3 %(质量分数)减小
D. 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0. 75a kJ
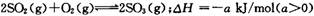 ,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是
,经2 min达到平衡状态,反应放热0. 25a kJ。下列判断正确的是A 在1 min时:
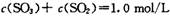
B. 2 min内:
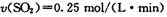
C. 若再充入2mol SO3,达平衡时SO3 %(质量分数)减小
D. 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0. 75a kJ
A
根据S原子守恒可知A是正确的。由热化学方程式知每消耗2mol二氧化硫,1mol氧气生成2mol三氧化硫时就放出akJ的热量,若放出0. 25a kJ则消耗0.5mol二氧化硫,0.25mol氧气生成,0.5mol三氧化硫。所以B不正确,应是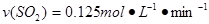 。若平衡再充入2mol SO3,虽然平衡向逆反应方向移动,但三氧化硫的转化率降低,所以SO3%应该增大。原平衡相当于2mol SO3和1mol氧气,在反应条件相同的情况下,若起始时向反应容器中充入2mol SO3,则SO3和分解率将增大,所以平衡时吸收热量要大于0. 75a kJ。答案是A。
。若平衡再充入2mol SO3,虽然平衡向逆反应方向移动,但三氧化硫的转化率降低,所以SO3%应该增大。原平衡相当于2mol SO3和1mol氧气,在反应条件相同的情况下,若起始时向反应容器中充入2mol SO3,则SO3和分解率将增大,所以平衡时吸收热量要大于0. 75a kJ。答案是A。
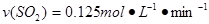 。若平衡再充入2mol SO3,虽然平衡向逆反应方向移动,但三氧化硫的转化率降低,所以SO3%应该增大。原平衡相当于2mol SO3和1mol氧气,在反应条件相同的情况下,若起始时向反应容器中充入2mol SO3,则SO3和分解率将增大,所以平衡时吸收热量要大于0. 75a kJ。答案是A。
。若平衡再充入2mol SO3,虽然平衡向逆反应方向移动,但三氧化硫的转化率降低,所以SO3%应该增大。原平衡相当于2mol SO3和1mol氧气,在反应条件相同的情况下,若起始时向反应容器中充入2mol SO3,则SO3和分解率将增大,所以平衡时吸收热量要大于0. 75a kJ。答案是A。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
2HBr(g)。已知加入1 mol H2和2 mol Br2时,达到平衡后生成a mol HBr(见下表的“已知”项),在相同条件下,且保持平衡时各组分的含量不变,对下列编号(1)~(3)的状态,填写表中的空白。
 CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是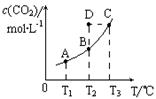
 4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白: 2Z(g)(正反应为放热反应),为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
2Z(g)(正反应为放热反应),为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )