题目内容
(14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:

请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:

写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
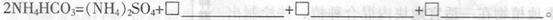
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。

请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:

写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55
 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+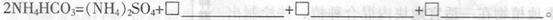
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
28.(14分)(1)用电池外壳锌皮与硫酸作用生产硫酸锌时的副产物(2分)
(2)MnO2(s)+C(s) = MnO(s)+CO(g) △H=+54.2kJ·mol-1 (3分)
(3)1; MnCO3↓;1;H2O;1;CO2↑(全对给2分)
(4)H2O2(或其他氧化剂)(2分); 3.7~8.6(2分)
(5)Mn2++ 2 H2O -2e-= MnO2 +4H+(3分)
(2)MnO2(s)+C(s) = MnO(s)+CO(g) △H=+54.2kJ·mol-1 (3分)
(3)1; MnCO3↓;1;H2O;1;CO2↑(全对给2分)
(4)H2O2(或其他氧化剂)(2分); 3.7~8.6(2分)
(5)Mn2++ 2 H2O -2e-= MnO2 +4H+(3分)
试题分析:(1)该流程中用硫酸浸取的时候可以生成氢气;(2)两个方程式相加再除以2得到所求的方程式,两个△H相加除以2即得反应的△H;(3)该流程的目的是制取碳酸锰,分析反应物相互交换成分后除生成碳酸锰之外,还会生成二氧化碳和水;(4)将
Fe2+氧化为Fe3+,加入氧化剂,还不能引入新的杂质,故需加入双氧水,还原为水,不引入新的杂质,控制pH使铁离子转化为沉淀,锰离子不能转化为沉淀,故需控制pH为3.7~8.6;(5)硫酸锰溶液中的锰离子转化为二氧化锰发生氧化反应,在阳极上发生,故阳极反应为锰离子失去电子结合水中的氧生成二氧化锰和氢离子。

练习册系列答案
相关题目
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3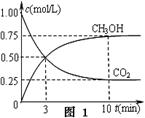
 SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
 NH4++OH-达到平衡后,升高温度平衡正向移动
NH4++OH-达到平衡后,升高温度平衡正向移动