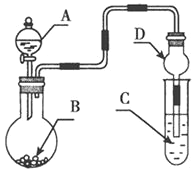
题目内容
【题目】用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是( )
A.苯中的甲苯(溴水、分液)
B.溴乙烷中的乙醇(水、分液)
C.乙醇中的水(CaO,蒸馏)
D.溴苯中的溴(NaOH溶液、分液)
【答案】A
【解析】解:A.甲苯与溴水不反应,易溶于苯,加入溴水不能除去杂质,故A错误;
B.乙醇易溶于水,而溴乙烷不溶于水,可用水分液,故B正确;
C.水易与CaO反应生成氢氧化钙,增大沸点差,蒸馏可分离,故C正确;
D.溴与氢氧化钠反应,溴苯不溶于水,可分液,故D正确.
故选A.

【题目】下列离子组在溶液中能大量共存且通入相应气体后仍能大量存在的是
选项 | 离子组 | 通入气体 |
A | Cl-、Ca2+、HCO3-、NH4+ | 氨气 |
B | Ba2+、Na+、Cl-、NO3- | 二氧化硫 |
C | Al3+、HCO3-、SO | 氯化氢 |
D | K+、Na+、HSO | 二氧化碳 |
A. A B. B C. C D. D
【题目】从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应:N2(g)+3H2(g)2NH3(g)△H=-93kJmol-1。试根据表中所列键能数据,计算a为( )
化学键 | H-H | N-H | N≡N |
键能/kJmol-1 | 436 | a | 945 |
A.360kJ/molB.391kJ/molC.1288kJ/molD.1474kJ/mol
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH 液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:________________。
(2)下图是某笔记本电脑用甲醇燃料电池的结构示意图。
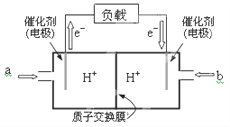
放电时甲醇应从______处通入(填“a”或“b”),电池内部H+向_____(填“左”或“右”)移动。写出电池负极的电极反应式:_______________________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a 的数值:_______________。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H =________。
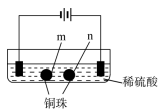
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜