题目内容
【题目】近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上。已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。根据下列示意图回答有关问题:
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
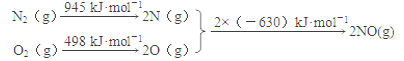
写出该反应的热化学方程式:_________________
(2)空燃比较易产生CO,有人提出可以设计反应2CO(g)===2C(s)+O2(g)来消除CO的污染。判断该设想是否可行,并说出理由:_____________________。
(3)在汽车上安装三元催化转化器可实现反应:
(Ⅱ)2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0 。若该反应在恒压的密闭容器中进行,则下列有关说法正确的是_______________
N2(g)+2CO2(g) ΔH <0 。若该反应在恒压的密闭容器中进行,则下列有关说法正确的是_______________
A.其他条件不变,增大催化剂与反应物的接触面积,能提高反应速率,使平衡常数增大
B.平衡时,其他条件不变,升高温度,逆反应速率增大,正反应速率减小
C.在恒温条件下,混合气体的密度不变时,反应达到化学平衡状态
D.平衡时,其他条件不变,增大NO的浓度,反应物的转化率都增大
(4)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。以下说法正确的是__________。
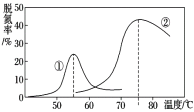
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.在该题条件下,两种催化剂分别适宜于55 ℃和75 ℃左右脱氮甲醇﹣空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,
该燃料电池的电池反应式为 2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)
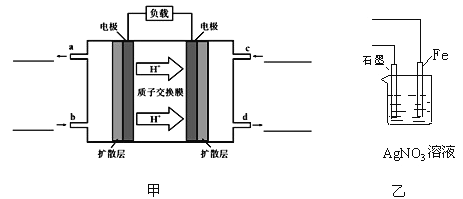
①负极的电极反应式为_______________,氧气从_______________(填b或c)口通入
②用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为________mL(标准状况)
【答案】 N2(g)+O2(g)===2NO(g) ΔH =+183 kJ·mol-1 不合理。该反应焓增、熵减,任何条件下都不能自发进行或该反应ΔH>0,ΔS<0,则ΔG>0 C C ![]() c 280 mL
c 280 mL
【解析】(1)本题考查焓变的计算,△H=反应物的键能总和-生成物的键能总和=(945+498-630×2)kJ·mol-1=+183kJ·mol-1;(2)本题考查化学反应进行的方向,根据△G=△H-T△S,此反应是吸热反应,即△H>0,根据反应方程式,属于熵增,即△S>0,因此△G>0,不能自发进行,此设计不可行;(3)本题考查化学平衡常数、影响化学反应速率的因素、化学平衡状态的判断,A、化学平衡常数只受温度的影响,因此使用催化剂,化学平衡常数不变,故错误;B、升高温度,正逆反应速率都增大,故错误;C、组分都是气体,因此气体质量不变,恒压状态下,反应前气体系数大于反应后气体系数,因此气体体积是减小的过程,即当密度不再改变,说明反应达到平衡,故正确;D、NO也是反应物,增大NO的浓度,CO的转化率增大,但NO的转化率降低,故错误;(4)考查影响化学平衡的因素,A、催化剂对化学平衡的移动无影响,故错误;B、反应前后气体系数之和不相等,反应前的气体系数之和大于反应后,增大压强,平衡向正反应方向移动,脱氮率增加,故错误;C、催化效率最高,说明是适宜温度,根据图像,即55℃和75℃,故正确;(5)本题考查电极反应式的书写和电化学的计算,①负极应是通燃料的一极为负极,即通甲醇的一极为负极,根据质子移动的方向,左边电极为负极,右边电极为正极,因此电极反应式为CH3OH+H2O-6e-=CO2+6H+,氧气从b口通入;②Fe极质量增重,说明Fe作阴极,电极反应式为Ag++2e-=Ag,正极反应式为O2+4H++4e-=2H2O,因此有2Ag+~4e-~O2,因此氧气的体积为5.4×22.4×1000/(4×108)mL=280ml。

 名校课堂系列答案
名校课堂系列答案