题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
| B.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
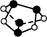
| D.0.5 mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S—S键 |

C
A中铁是过量的,氯气不足,所以反应中转移的电子数是0.2NA,A不正确。B中硫酸的物质的量是0.2 mol,但随着反应的进行,浓硫酸逐渐变稀,稀硫酸和铜不反应,因此转移电子数小于0.2NA,B不正确。选项C中阴离子和阳离子的物质的量之比都是1∶2,1 mol混合物中有1 mol阴离子,且两者的相对分子质量都是78,所以选项C正确。选项D中,先确定S原子和As原子,由于As和N同主族,所以要达到8电子稳定结构,需形成3个共价键,而S需形成2个共价键,所以图中●为As原子,○为S原子,可见存在As—As键、S—As键,但不存在S—S键,故D不正确。

练习册系列答案
相关题目


 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。

