题目内容
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
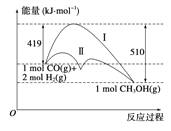
I、CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) 的△H= ______________________________kJ/mol
II、某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g) 甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)= _________________,计算此条件下该反应的平衡常数K= _________________。
CO(g)+H2O(g) 甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)= _________________,计算此条件下该反应的平衡常数K= _________________。
III、捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
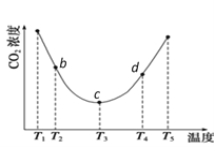
①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 ________________________________。
【答案】(2a+b)/3 0.2mol/(L·min) 1.8 C D < K b>K c >Kd
【解析】
I、CO可用于高炉炼铁,已知:①Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol,则1/3[①![]() +②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= (2a+b)/3kJ/mol;答案:(2a+b)/3;
+②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= (2a+b)/3kJ/mol;答案:(2a+b)/3;
II、①设反应的CO2为Xmol,
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L)4 8 0 0
变化量(mol/L)X X X X
平衡量(mol/L)4-X 8-X X X
由15min后达到平衡时CO2的转化率为75%,所以![]() =75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L
=75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L![]() 15min= 0.2mol/(L·min);
15min= 0.2mol/(L·min);
②上述条件下反应的平衡常数K=32![]() (1
(1![]() 5)=1.8;
5)=1.8;
答案:0.2mol/(L·min) ;1.8。
III、根据捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。A.Na2CO3、B.NaOH均能和CO2反应,可以用作工业捕碳剂,而C.CH3CH2OH、D.NH4Cl均不能和CO2反应,故不可以用作工业捕碳剂。所以答案:C、D;
(2)由图像可知,c点曲线出现折点,c点前半段,由于为温度低,化学反应速率慢,在此时间没有平衡,因此一直在正向移动,CO2的浓度降低;c点后半段,由于温度高,反应在此时间内达到平衡,因此后判断变化趋势,体现了温度对平衡移动的影响,温度升高,CO2的浓度升高,逆向移动,逆反应为吸热反应,则正反应为放热反应。①c点和d点,均处于平衡状态,正反应速率等于逆反应,温度越高,反应速率越大,则c点处的正逆反应速率小于d点处的正逆反应速率,则有V逆c <V正d;
②根据图像该化学反应随温度的升高,平衡逆向移动,所以该反应是放热反应,b、c、d三点温度逐渐升高,所以b、c、d三点的平衡常数K b >K c>Kd ,所以答案:K b>K c >Kd。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D